01 论文概要
2023年2月,南通大学陈罡教授课题组在《Brain, Behavior, and Immunity》上发表了题为“Schwann cell-derived CXCL2 contributes to cancer pain by modulating macrophage infiltration in a mouse breast cancer model”的研究论文,发现小鼠乳腺癌慢性疼痛模型中,在肿瘤应激下施万细胞大量表达CXCL2诱导巨噬细胞浸润到坐骨神经中,并伴有机械超敏反应和持续的自发伤害感受。该文在细胞分子水平上丰富了人们对周围神经系统在肿瘤生长过程中的认识,贯通了巨噬细胞与周围感觉神经对肿瘤诱导疼痛的过程,为抗癌止痛药的开发提供新的靶点。

02研究背景介绍
疼痛在癌症患者中非常普遍,尤其是在疾病的晚期。癌症疼痛会导致功能不良、日常活动受限、残疾和生活质量的整体损害,现有的癌症疼痛的治疗主要是旨在减小肿瘤大小,包括放疗、化疗和手术,这些疗法虽然可有效降低癌症相关疼痛,但都伴有严重的不良副作用,而癌症疼痛的机制仍不完全清楚。此外,癌痛的缓解通常是用阿片类药物,然而其缓解癌痛的效果基本是微乎其微,并且由于其不良反应而被避免使用。巨噬细胞(macrophages)在神经性疼痛中的作用已被广泛研究,最近的研究表明,癌症患者的神经病理状况受周围神经巨噬细胞浸润的调节[1]。巨噬细胞的募集和扩增可能是由于趋化因子的上调,施万细胞(Schwann cell)在巨噬细胞介导的疼痛中的作用首先在神经性疼痛模型中得到证实[2]。神经损伤后,施万细胞可以产生趋化因子、细胞因子和细胞外蛋白以调节神经炎症和巨噬细胞浸润。一系列趋化因子及其受体,包括CCL2 / CCR2,CXCL5 / CXCR2和CXCL12 / CXCR4,已被确定为癌痛调节的信号。这些趋化因子可能直接吸引免疫细胞,尤其是巨噬细胞,进而引起炎症。由于肿瘤细胞与感觉神经之间独特的相互作用,癌痛的机制与其他慢性疼痛疾病不同,此外肿瘤微环境是由于其多种细胞成分,包括肿瘤细胞、浸润淋巴细胞、神经胶质细胞及其相互作用产物。而在肿瘤微环境中癌细胞,免疫细胞和神经系统之间的相互作用是如何影响癌痛的发作和持续性的机制也尚不清楚。
03结果分析与阐述
已有许多研究表明在肿瘤微环境中,肿瘤细胞和炎症细胞可以释放许多作用于施万细胞的介质,进一步传播神经炎症[3]。癌细胞,免疫细胞和神经系统之间的相互作用如何影响癌痛的发作和持续性的机制尚不清楚。在此,作者首先通过 CXCR2 拮抗剂免疫阻断或CXCL2中和性抗体靶向阻断CXCL2/CXCR2 信号传导(图1 A-J),不仅可以强有力地减弱机械超敏反应和持续的自发伤害感受,还可以防止巨噬细胞在坐骨神经中的募集。坐骨神经施万细胞中CXCL2的条件性敲低有效抑制癌细胞诱导的机械超敏反应、持续自发伤害感受和坐骨神经巨噬细胞募集,进一步证实了这个结论(图2 A-E)。这些结果表明,来源于施万细胞的CXCL2诱导巨噬细胞浸润周围神经,这可能与肿瘤诱导持续性自发伤害感受的发展有关。
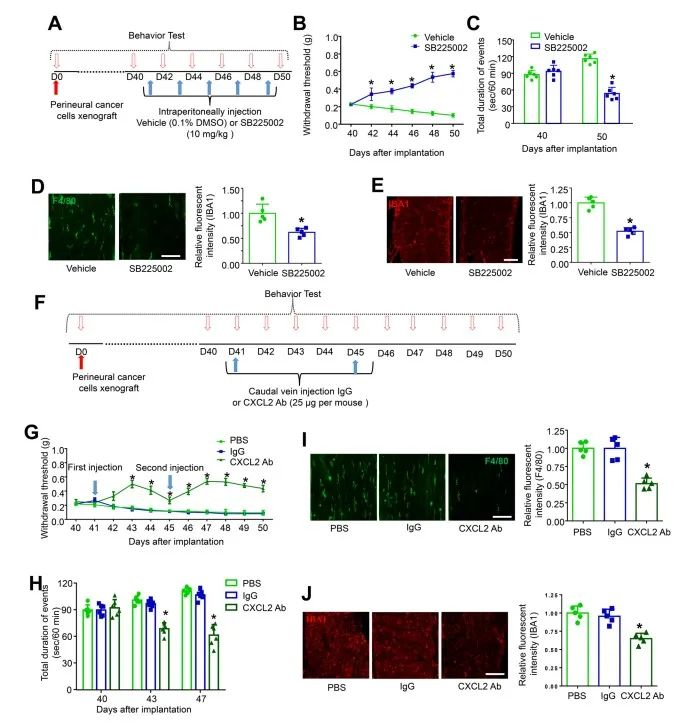
图1 CXCL2/CXCR2信号传导的拮抗缓解了肿瘤诱导的持续自发伤害感受并减少了巨噬细胞渗入坐骨神经
(图源:Zhang YH, et al., Brain, Behavior, and Immunity, 2023)
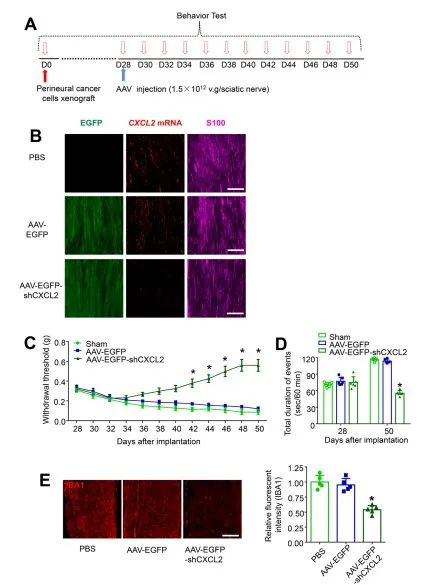
图2 坐骨神经施万细胞中CXCL2条件性敲低减轻了肿瘤诱导的巨噬细胞浸润和体内持续自发伤害感受
(图源:Zhang YH, et al., Brain, Behavior, and Immunity, 2023)
为了寻求肿瘤诱发性疼痛的巨噬细胞起源,作者通过腹膜内注射脂质体氯膦酸盐(liposome clodronate)来消耗造血巨噬细胞。结果表明,巨噬细胞缺失不仅降低了肿瘤疼痛模型小鼠的机械超敏反应和持续的自发伤害感受时间,而且显著降低了小鼠坐骨神经中的巨噬细胞数量(图3 F-I)。这些结果表明,肿瘤疼痛模型小鼠浸润坐骨神经的巨噬细胞主要来源于外周血液循环,而不是来自坐骨神经常驻巨噬细胞的增殖。
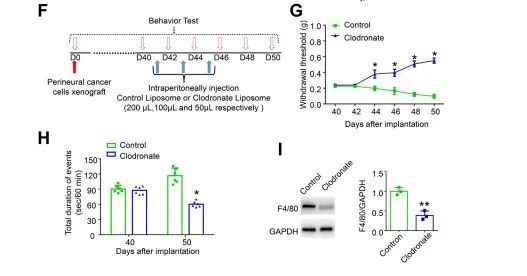
图3 巨噬细胞耗竭对神经周围癌细胞植入诱导的持续自发伤害感受和疼痛样行为的影响
(图源:Zhang YH, et al., Brain, Behavior, and Immunity, 2023)
进一步的机制研究表明,发现随着CXCL2分泌的增加,施万细胞中HIF-1α的表达也显著增加(图4 A),并且细胞内ROS水平呈下降趋势(图4 B-C)。Ref-1是HIF-1α转录活性的中枢调节因子[4]。Ref-1在老鼠乳腺癌细胞中的表达显著高于正常乳腺组织,与施万细胞共培养后进一步升高(图4F)。E3330是一种特异性Ref-1抑制剂,可显着缓解乳腺癌细胞诱导的施万细胞中CXCL2表达的增加。在神经周围癌细胞植入后41、43、45和47天腹膜内注射E3330,结果表明,E3330显著减轻了癌症诱导的后爪机械超敏反应和持续的自发伤害感受(图4 H-J)。这些证据都证实乳腺癌细胞释放的 Ref-1 通过 HIF-1α/ROS 途径诱导施万细胞中 CXCL2表达增加。
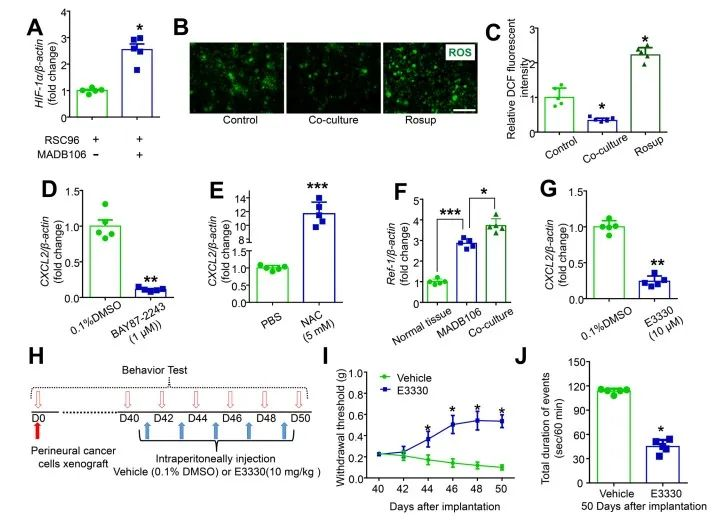
图4 乳腺癌细胞释放的Ref-1通过HIF-1α/ROS途径诱导雪旺细胞中CXCL2表达增加
(图源:Zhang YH, et al., Brain, Behavior, and Immunity, 2023)
04 结果分析与阐述
综上所述,该研究结合细胞生物学、免疫化学、动物行为学及统计学等多种手段,揭示了乳腺癌细胞释放的Ref-1通过HIF-1α/ROS途径诱导雪旺细胞中CXCL2表达的增加,从而吸引巨噬细胞到周围感觉神经来产生肿瘤诱导的疼痛样行为。不足的是,该研究中的移植模型的局限性在于缺乏原位植入,此外也不能完全排除其他自分泌或旁分泌因子的作用,这些因素可能在癌细胞诱导的巨噬细胞浸润中发挥作用,并且乳腺癌细胞对坐骨神经神经元及中枢系统的影响也值得继续深入。
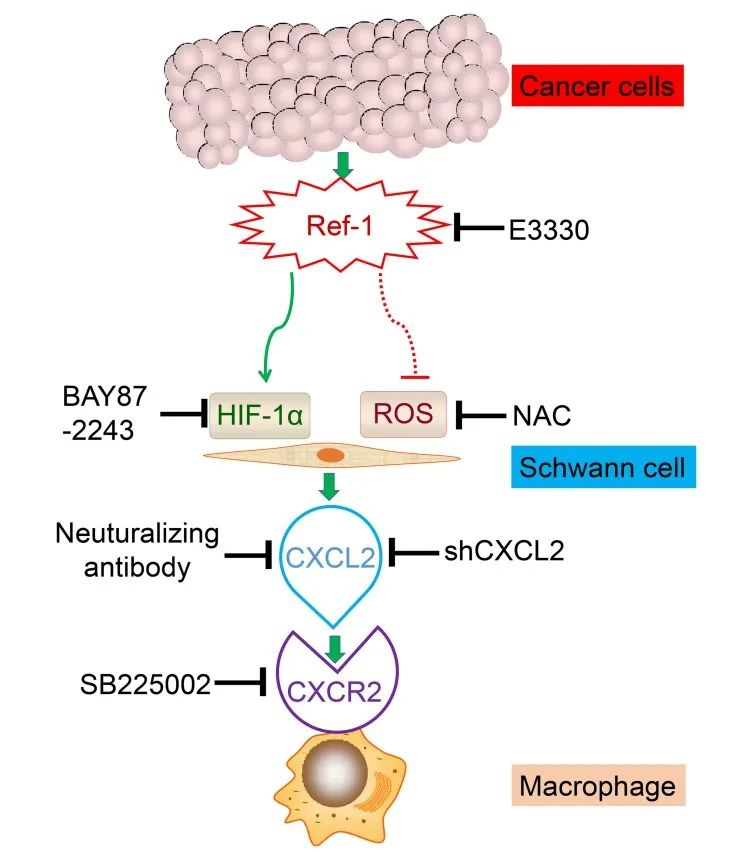
图5 总结图:施万细胞分泌CXCL2募集巨噬细胞并引起癌痛的机制图
(图源:Zhang YH, et al., Brain, Behavior, and Immunity, 2023)
吉 凯 助 力
本文AAV9病毒由吉凯基因提供,助力高水平的科学研究。
通讯作者简介:
陈罡,教授,博士生导师。中国科学院神经科学研究所博士,哈佛大学医学院、杜克大学医学中心博士后、杜克大学医学中心助理教授。现任南通大学医学院院长,江苏特聘教授,江苏特聘医学专家。
参考文献(reference list):
[1] Martyn, G.V., Shurin, G.V., Keskinov, A.A., Bunimovich, Y.L., Shurin, M.R., 2019. Schwann cells shape the neuro-immune environs and control cancer progression. Cancer Immunol Immun 68 (11), 1819-1829
[2] De Logu, F., Nassini, R., Materazzi, S., Goncalves, M.C., Nosi, D., Degl'Innocenti, D.R., Marone, I.M., Ferreira, J., Li Puma, S., Benemei, S., Trevisan, G., Souza, D., De Araujo, M., Patacchini, R., Bunnett, N.W., Geppetti, P., 2017. Schwann cell TRPA1 mediates neuroinflammation that sustains macrophage-dependent neuropathic pain in mice. Nat Commun 8 (1), 1887.
[3] Demir, I.E., Kujundzic, K., Pfitzinger, P.L., Saricaoglu, O.C., Teller, S., Kehl, T., Reyes, C.M., Ertl, L.S., Miao, Z., Schall, T.J., Tieftrunk, E., Haller, B., Diakopoulos, K.N., Kurkowski, M.U., Lesina, M., Kruger, A., Algul, H., Friess, H., Ceyhan, G.O., 2017. Early pancreatic cancer lesions suppress pain through CXCL12-mediated chemoattraction of Schwann cells. P Natl Acad Sci USA 114 (1), E85-E94.
[4] Malfatti, M.C., Gerratana, L., Dalla, E., Isola, M., Damante, G., Di Loreto, C., Puglisi, F., Tell, G., 2019. APE1 and NPM1 protect cancer cells from platinum compounds cytotoxicity and their expression pattern has a prognostic value in TNBC. J Exp Clin Cancer Res 38 (1), 309.
