转移是乳腺癌发病和死亡的主要原因,约占乳腺癌相关死亡的90%。临床上,乳腺癌可转移到不同的继发部位,包括骨、肺、肝和脑,但很少转移到肾脏等器官,这种癌细胞优先扩散至特定器官称为器官转移特异性。以这种差异为例,研究人员探究了器官特异性转移倾向背后的机制。2024年9月17日,美国德克萨斯大学MD安德森癌症中心Raghu Kalluri团队(周许年、Valerie S. LeBleu、Eliot Flether-Sananikone为共同第一作者)在Nature Cancer杂志发表了文章“Vascular heterogeneity of tight junction Claudins guides organotropic metastasis”, 研究表明不同器官EC连接的异质性可能是与乳腺癌相关的器官亲和性的关键因素。

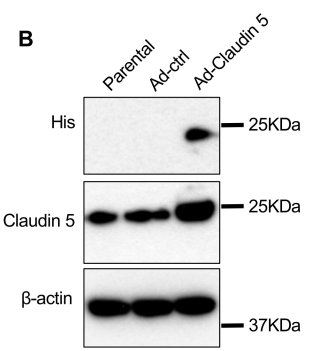
WB显示Ad-Claudin 5组Cldn5显著过表达
研究结果
1、肺纤维化(LF)或肾纤维化(KF)诱导肺特异性血管重构
为了评估转移前环境对肺转移的影响,作者利用4T1乳腺荷瘤小鼠中诱导肺纤维化产生炎症组织微环境,发现LF增加肺转移和表面肺结节;随后又诱导了肾纤维化,发现KF也促进肺转移和表面肺转移结节,但不促进肾转移。此外,与皮肤伤口愈合反应相关的纤维化重塑对肺转移没有影响,也不会诱导转移到其他器官。作者进一步测试了癌细胞植入肾实质后形成肿瘤的能力,发现癌细胞在肾实质形成肿瘤,并伴有肺转移。为了探索与LF和KF诱导的肺转移增强相关的潜在机制,作者评估了KF小鼠(LoKF)健康肺(HL)、健康肾(HK)、LF肺、KF肾和肺的整体转录组学变化,数据分析表明了KF诱导的肺血管重塑的潜在调节剂的作用。流式细胞术进一步评价肺免疫微环境对LF和KF的反应,发现中性粒细胞可能在辅助肺转移中起协同作用,但并不固有地决定肾转移。进一步评估纤维化肾脏分泌的细胞因子和趋化因子对血管重塑和促进转移的影响,作者使用健康小鼠、皮肤伤口小鼠、LF小鼠和KF小鼠的血清进行了靶向细胞因子阵列。在与血管重构相关的细胞因子中,与HK和HL相比,KF中Ang2的上调差异最大。进一步实验发现Ang2在与KF相关的肺转移小鼠的血清中上调,而其影响可能是在LF的背景下局部驱动的。以上表明,Ang2是KF诱导和LF诱导的肺转移增强的潜在介质。
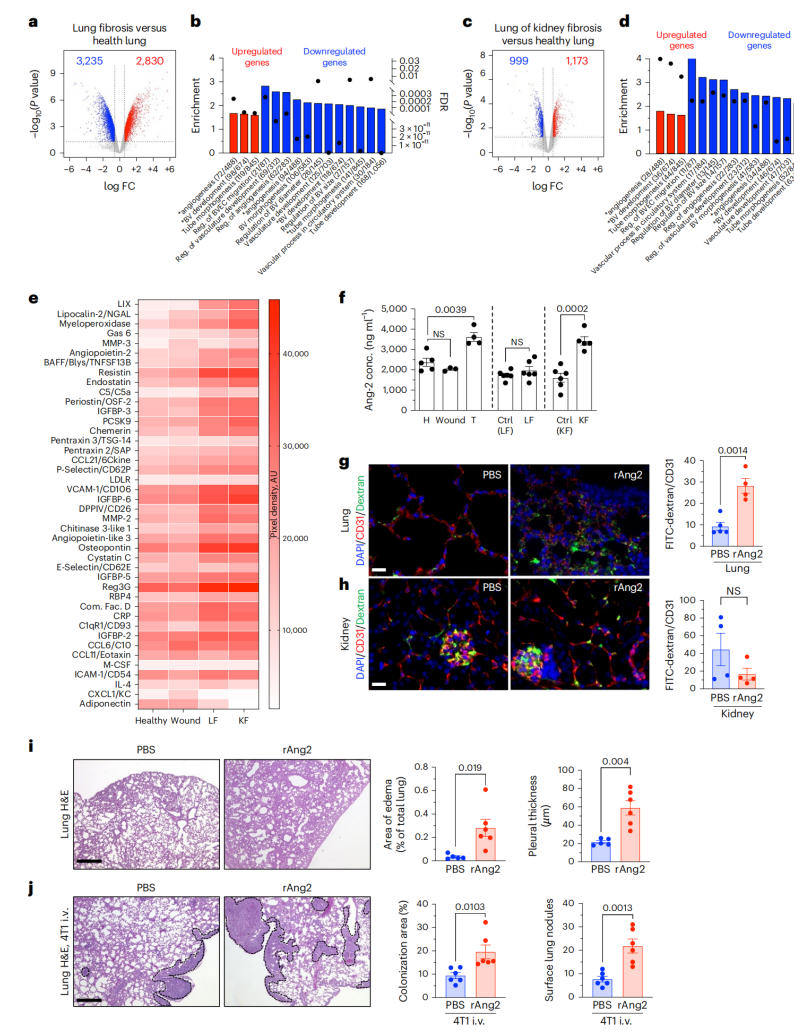
图1. Ang2介导纤维化诱导的肺转移
2、Ang2-FOXO1信号传导抑制肺上皮细胞中的Claudin 5
接下来,作者进一步评估发现在纤维化诱导的肺转移中,Ang2破坏肺血管通透性,并且Ang2可以中和逆转KF诱导的肺转移增强。Ang2先前通过破坏紧密连接(TJ)完整性与乳腺癌转移有关,Cldns是TJ细胞间粘附复合物的关键结构和功能成分。对关键TJ成分的评估显示,与健康肝脏和HK相比,Cldn5在HL中的表达水平更高。鉴于肺内皮TJs中Cldn5的表达丰富,作者试图确定Ang2诱导的肺血管通透性增加是否部分是Cldn5下调的结果,正如之前其他研究所支持的那样,Ang2在小鼠肺内皮细胞中下调Cldn5。为了确定与Ang2介导的Cldn5下调相关的信号事件,作者评估了使用rAng2治疗的肺内皮细胞中的FOXO1,发现Ang2通过FOXO1的核富集下调Cldn5。
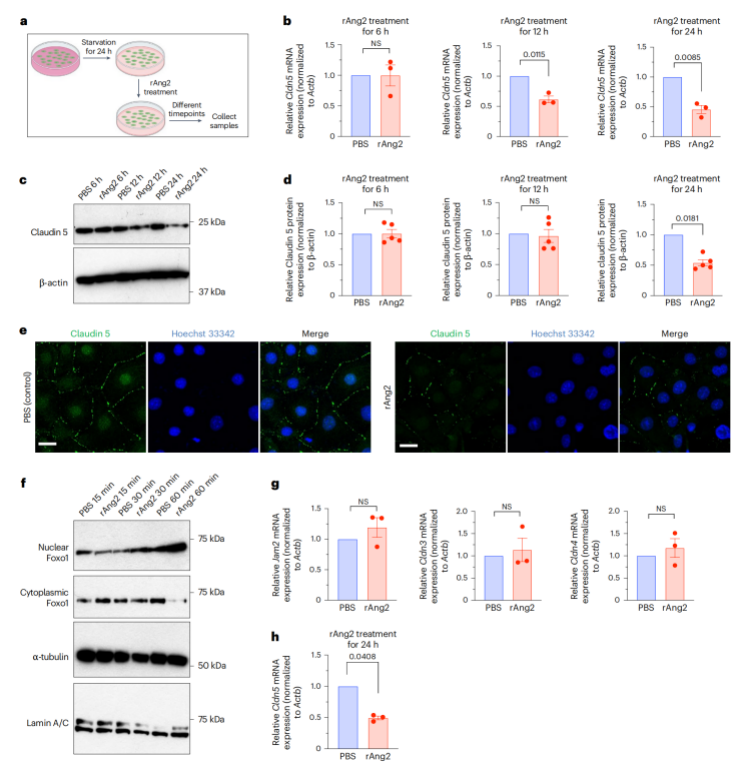
图2. Ang2通过FOXO1的核富集下调Cldn5
3、Ang2通过破坏Cldn5 TJ促进肺转移
为了确定Ang2降低Cldn5在肺转移中的直接作用,作者进行了挽救实验,在静脉输注4T1癌细胞之前,通过气管内注射过表达Cldn5的腺病毒(Ad-Cldn5),在有或没有给药rAng2的情况下过量表达Cldn5。体内研究发现rAng2处理后Cldn5+ CD31+面积减少,而气管内Cldn5过表达阻止了这种减少,表明rAng2治疗显著增加了4T1的肺部定植。然而,在这种情况下,同时过表达Cldn5阻止了4T1肺定植的增加,下调Cldn5增加肺转移,该研究结果支持了血管内皮细胞中的Claudin 5在肺部转移过程中扮演着重要的守门人角色。进一步研究发现抑制Cldn2和Cldn10导致肾脏EC TJs的不稳定和血管通透性受损,从而导致非典型的肾脏转移形成,并随着炎症纤维化而增强。以上结果表明,肺中的Cldn5对Ang2介导的血管不稳定和肺转移非常敏感,并且转移的器官亲和性,至少部分是由内皮TJ组织特异性成分驱动的。
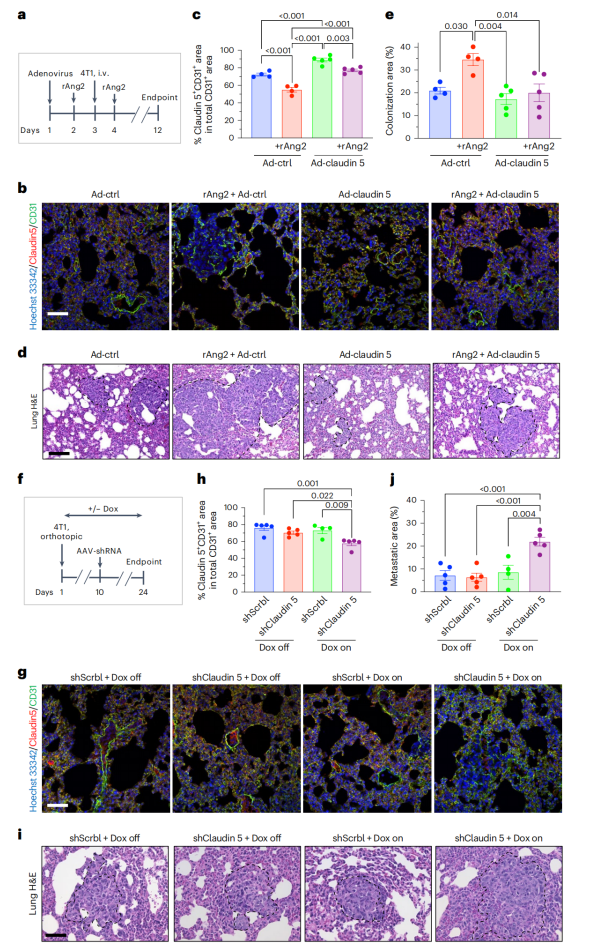
图3. Cldn5在肺4T1细胞外渗中的关键作用
小结
本研究发现Ang2 介导的肺内皮细胞Cldn5的抑制促进了肺转移,而炎症纤维化微环境增强了这一过程,并通过抗Ang2阻断抗体阻止了这一过程,抑制Cldn2和Cldn10足以诱导肾转移的出现。本研究阐明了器官特异性血管异质性在决定嗜器官的转移中的影响,并且这一作用不依赖于癌细胞的内在机制。
