社交行为是物种繁衍生存重要的本能行为。个体依赖社交行为建立关系、互相支持、共享资源和信息,维持个体正常社会属性,进而确保群体的生存和发展。而社交障碍——社交互动中出现的如沟通、建立关系和适应社会环境持续性困难,影响了个体的工作效率和生活质量。现代社会的工作长时间快节奏、高压力导致社交障碍的发生越来越常见。在众多的精神疾病中社交障碍经常伴发出现,例如孤独症、精神分裂症等。然而社交障碍的神经机制尚不明确。
2023年11月21日,空军军医大学武胜昔团队在Neuron在线发表题为 CB1R dysfunction of inhibitory synapses in the ACC drives chronic social isolation stress-induced social impairments in male mice 的研究论文。该研究是在武胜昔团队前期证明前扣带回是社交行为关键靶点的基础上,进一步解释了由慢性社会隔离这种环境因素所诱发社交障碍的神经机制。

慢性社会隔离是一种常见的环境刺激,可以诱发攻击性增强、社会性降低、焦虑等行为异常。既往研究曾对慢性社会隔离进行全脑筛查发现包含前扣带回皮层(Anterior cingulate cortex, ACC)在内的多个脑区出现明显的功能异常。然而具体引起社交障碍的脑区靶点和神经机制仍未阐明。
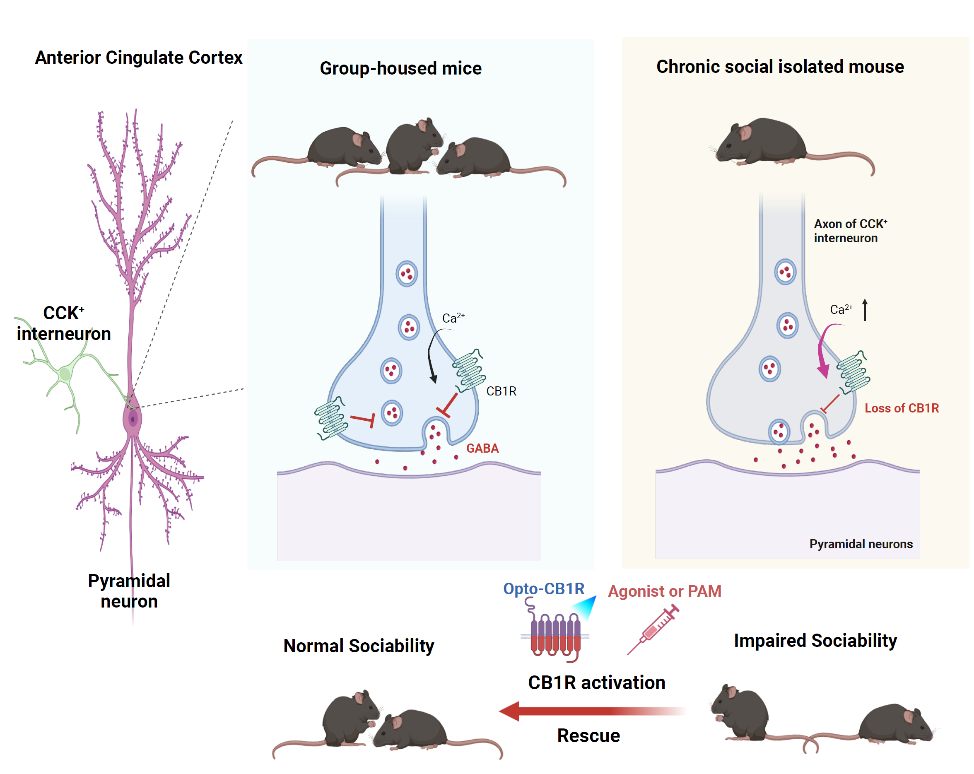
武胜昔团队构建了慢性社会隔离小鼠模型,通过多脑区筛查并明确了ACC区域与该小鼠模型社交障碍存在因果关系,发现社会隔离导致ACC局部抑制性突触功能增强,抑制性神经递质释放增多,引起局部突触稳态失衡。利用电生理记录及免疫电镜等手段证实这种稳态失衡源自于胆囊收缩素阳性(Cholecystokinin+, CCK+)中间神经元与锥体神经元所形成的抑制性突触前膜的CB1R减少,进而引发GABA释放增加导致的。通过光遗传学直接调控CCK+中间神经元活动以及利用opto-XR策略或药理学调控CB1R功能等多种途径均能够显著改善慢性社会隔离导致的社交障碍。该研究证实了ACC是慢性社会隔离诱发社交障碍的关键脑区,而CB1R介导的突触稳态失衡是其内在关键机制。该研究为理解社交障碍的病理机制及开发潜在治疗手段提供了重要理论依据。
原文链接:https://doi.org/10.1016/j.neuron.2023.10.027
和元助力
和元生物有幸为研究者提供实验中使用的AAV病毒载体,以实际行动助力神经科学研究!
如您有相关业务需求,请联系和元生物客服(微信/电话):15800353038
# END #
