癌症耐药性是癌症治疗中的一个重大挑战,导致疗效不佳或治疗后复发。当前,研究人员利用前沿技术加深对肿瘤耐药机制的了解,尝试开发出可绕过肿瘤耐药机制的个体化联合疗法。
其中,单细胞蛋白质组学分析技术可在单细胞的分辨率上检测胞内信号通路相关的多重磷酸化蛋白,了解异质性肿瘤细胞的整个胞内信号网络,及其在药物作用下的变化,从而加速发现肿瘤耐药机制,为设计新型有效的肿瘤联合疗法及新靶点发现提供新的见解和指导。
图示肿瘤耐药发展路径
在阻断肿瘤的主要信号通路后,可能有部分肿瘤细胞通过其他信号旁路继续维持存活或增殖,导致耐药发生
来自加州理工学院David Baltimore课题组、西雅图系统医学研究院James R. Heath课题组和苏州系统医学研究所的Guideng Li课题组,在Nat Communications(IF: 14.919)上发表的一篇名为“Multi-omic single-cell snapshots reveal multiple independent trajectories to drug tolerance in a melanoma cell line”的文章,阐述如何利用单细胞多组学技术研究肿瘤的耐药性发展,以及如何寻找新的潜在治疗靶点。

文章摘要
![]()
通过高维空间细胞状态确定单个细胞的轨迹,对于理解从细胞分化到药物处理后的疾病细胞表观遗传学反应等生物学变化是一个巨大的挑战。该研究通过理论和实验相结合的方式,确定了BRAFV600E突变的单个黑色素瘤细胞从药物敏感到药物耐受状态之间的发展轨迹。尽管单细胞组学工具可以帮助生成某个时间点的细胞状态图谱,但确定单个细胞的空间轨迹可能会被随机的细胞状态切换所混淆。
研究人员在药物处理后5天时间内分析了肿瘤细胞的一系列信号通路、细胞表型和代谢调节因子,揭示了在药物敏感和药物耐受状态之间的两条路径的细胞状态变化。特定细胞的发展轨迹取决于谱系限制性转录因子的药物反应水平。每条轨迹都显示出独特的药物敏感性,揭示了同基因细胞群体中适应性耐药发展的新模式。
研究思路
![]() 建立BRAFi诱导的黑色素瘤细胞耐药模型
建立BRAFi诱导的黑色素瘤细胞耐药模型
建立BRAFi诱导的黑色素瘤细胞耐药模型

通过单细胞多组学技术检测耐药发展中各种蛋白和代谢物的变化

降维分析显示肿瘤耐药发展的不同轨迹

通过临界点分析确定轨迹分叉的关键调节因素,即潜在治疗靶标
研究结果
![]()
1
通过单细胞蛋白组和代谢组分析揭示黑素瘤细胞耐药途径
Career In Business
研究人员利用病人来源的BRAFV600E突变黑素瘤细胞系(M397),建立了靶向抑制剂诱导的快速药物耐受模型。在BRAF抑制剂(BRAFi)作用下,这些高度可塑性细胞从初始的药物敏感状态转变成后期耐药状态(图1a),研究人员通过单细胞条形码芯片(SCBC)进行功能蛋白质组和代谢物分析,研究这一过程中相关的表型标志物和致癌信号标志物、肿瘤信号转导、细胞增殖和代谢活动等,洞察肿瘤耐药产生的关键机制。
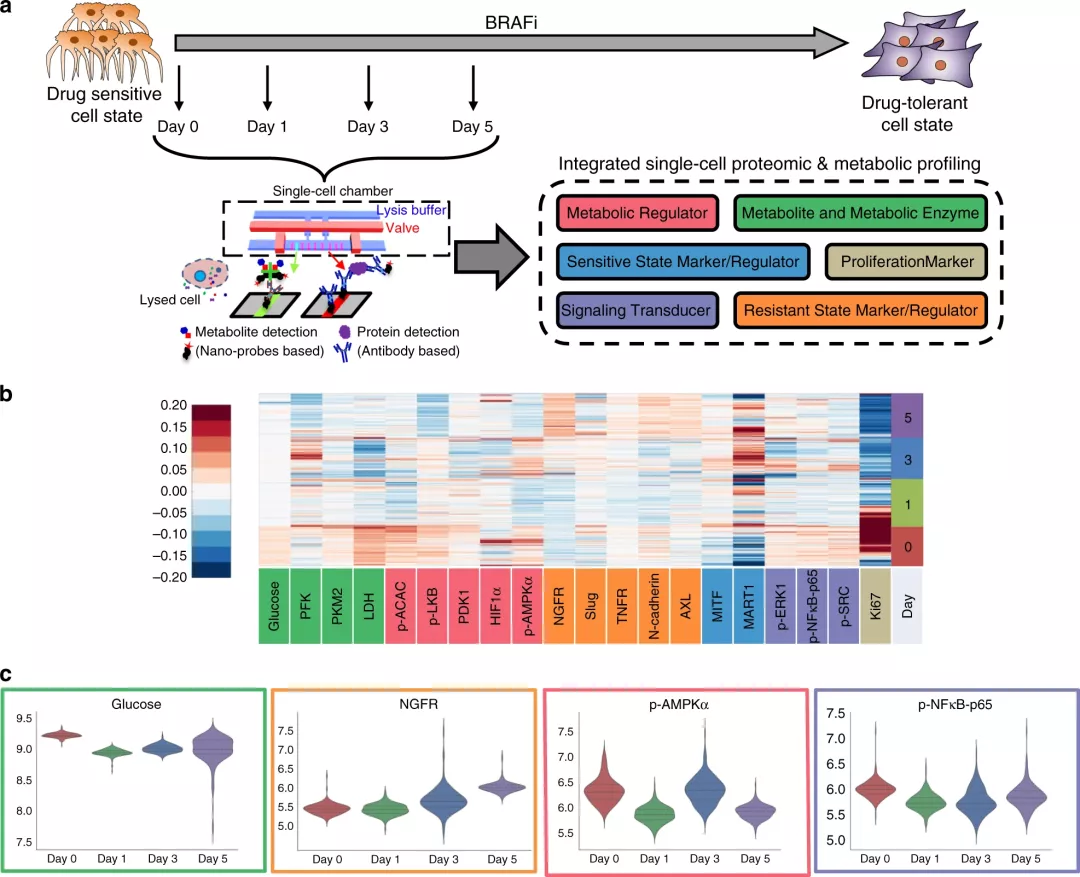
图1. 黑素瘤M397细胞在BRAFi处理不同天数后采用IsoPlexis单细胞蛋白组和代谢组芯片进行分析
在BRAFi处理后0、1、3、5天,M397细胞通过SCBC中成千上万个微室分离单细胞,然后对每个单细胞进行原位裂解,释放其胞内组分。每个微室含有全套条形码阵列,通过捕获抗体或分子探针与特定靶蛋白或代谢物结合(图1a)。
研究结果显示(图1b)
|
BRAFi 处理后 |
M397黑色素瘤细胞的单细胞蛋白质组 和代谢组变化 |
|
D0 |
· 许多分析标志物的基线水平表现为广泛异质性,如Ki67的异质性表达提示细胞群体中既有快速分裂,也有缓慢分裂的细胞。
· 细胞对葡萄糖的高度摄取、代谢酶乳酸脱氢酶(LDH)和PKM2的表达一致。 |
|
D1 |
· 细胞对葡萄糖的摄入及大多数代谢调节因子和信号通路以及Ki67表达受到抑制,表明BRAFi治疗有效的阻断了相关的致癌信号通路。
· 仍有一小群细胞Ki67水平较高,表明药物反应迟缓。 |
|
D3 |
· 短暂的细胞分化,随即去分化,表现为MART1表达先升高(D3)后降低(D5)。
· 许多分析物急剧升高,在D5下降,包括代谢酶(p-LKB除外)、所有耐药状态标志物及调节因子(Slug除外),所有代谢酶,所有信号通路磷酸化蛋白,说明细胞状态转换可能发生在D3这个时间点。 |
|
D5 |
· 葡萄糖摄取恢复到接近D0水平,但异质性升高。
· Ki67进一步降低,异质性相比D0急剧降低。
· 大部分细胞进入衰老状态,但凋亡细胞死亡率未显著升高。
· 上皮-间充质转化(EMT)相关转录因子Slug的变异和丰度增加,表明一些细胞倾向于向间充质表型转化。
· 药物抗性有关因子,如AXL、N-cadherin、NGFR和TNFR水平有所提高。
*以上提示,M397细胞在D5已开始产生了耐药。 |
因此,单细胞蛋白质组学和代谢组的联合分析,提供了证据表明D1初始药物反应、D3药物诱导细胞状态变化、D5出现药物耐受,有助于早期发现药物抵抗,而无需等到数周后出现细胞增殖才能判断耐药。
2
降维分析提示多种细胞发展轨迹
Career In Business
通过降维分析显示药物处理后单细胞多标志物随时间的协调变化。FLOW-MAP分析显示,M397黑色素瘤细胞随着药物处理时间延长,呈现不同的群体聚集特点及演变轨迹:
在BRAFi处理前(d0)
大多数M397细胞表达蛋白水平均一,部分蛋白表达水平差异较大,如N-cadherin、MITF、HIF1α、Ki67和MART1。
一小部分细胞表达低水平的Ki67、MITF和MART1(图2中MITF、MART1和Ki67方框中的虚线部分),提示这是一群去分化、分裂缓慢的细胞。
在BRAFi处理后,细胞群体最初分裂为两群,分布在FLOW-MAP图的两个区域。
在d1,大多数细胞聚集在d0细胞的右上方,而小部分亚群直接聚集在d0组的右侧。
这种趋势在d3处继续,大多数细胞聚集在d1上方,而少数细胞聚集在d1一小群细胞的右侧。
到d5时,所有细胞都聚集到图形的右方。
在d1和d3细胞分叉状态意味着细胞耐药朝上、下两种轨迹发展的可能性。
因此,对单细胞数据集的计算分析表明,在BRAFi适应的早期阶段出现了两种不同的药物反应轨迹。

图2. 单细胞蛋白组和代谢组学数据分析结果
3
Surprisal分析揭示两条不同的耐药发展轨迹
Career In Business
采用Surprisal分析单细胞数据,鉴定了两种主要的耐药发展模式:模式1和2(图3a)。这两个模式中所有的检测分析物的预测性表达与单细胞检测数据非常匹配,表明这两个模式重现了细胞在为期5天的药物处理过程中的所有分子特征的总体变化。每个模式的评分表示模式相关分析物在细胞中富集或抑制的程度,并将得分进行颜色编码对应到相应的分层图上(图3a)。
模式1的评分在上下两条路径上都从负值(蓝色)逐渐增加到正值(红色),并且在中间时间点有清楚的变化,表明在轨迹过渡中存在一个生物物理屏障(图3a),意味着细胞状态的转变及不同细胞状态之间的界限。考虑到模式1评分与Ki67表达负相关,与NGFR/AXL表达正相关,模式1评分随时间的变化似乎可以反映d1到d3期间从药物敏感状态到药物耐受状态的转换。
模式2也展现出类似的变化。值得注意的是,黑素瘤细胞表型转录因子MITF及其下游蛋白MART1的表达均与模式2评分呈负相关(图3b),提示两条路径的分叉可能与上述两种蛋白密切关联。
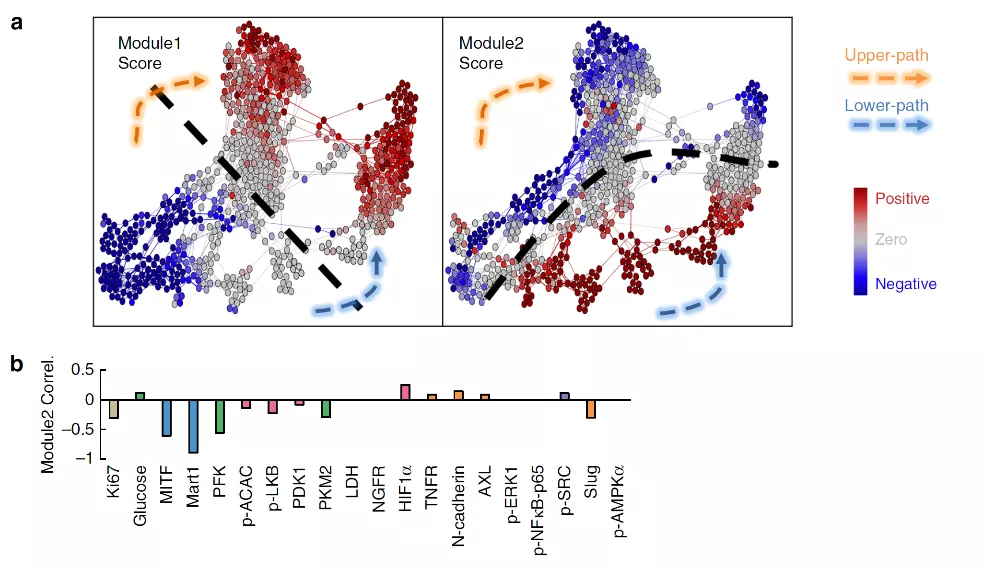
图3. Surprisal分析显示耐药发展的两种模式
Surprisal分析为细胞从药物敏感状态转变成耐药状态的上下两条路径提供了理论支持。研究人员后续通过一系列实验对此进行了验证。根据模式2,未经药物处理的细胞(D0)含有两种状态的细胞,可通过MITF和MART1的表达加以区分,其中MITF-Low细胞在药物处理后可能通过下面的路径转变,而MITF-High细胞则通过上面的路径发展。通过MITF-GFP报告基因细胞系分选出GFP高表达(MITF-high)和低表达(MITF-Low)的细胞,研究发现MITF-high细胞表达更高水平的Ki67和MITF以及更短的倍增时间,说明细胞表型从黑色素瘤系、高度增殖的状态转变成非黑色素瘤系、更具侵袭性的状态。
各种数据表明,即使在同基因细胞系中,在BRAFi处理后不同的细胞亚群也可能表现出不同的生物学行为。MITF-High和MITF-Low亚群可能代表了在药物治疗后分别遵循上、下两条独立路径发展的细胞。
4
通过临界点分析确定轨迹分叉的关键调节因子
Career In Business
IsoPlexis 商家主页
地 址: 暂无
联系人: 苗先生
电 话: 4001118515
传 真: 暂无
Email:Info.apac@isoplexis.com
