
期刊:Nat Commun
影响因子:16.6
伯豪技术服务:空间转录组测序
导读
睡眠剥夺是一个日益严重的问题,睡眠不足会影响认知、注意力和新陈代谢。睡眠和昼夜节律紊乱也与神经退行性疾病的发病率增加和加速进展有关,包括阿尔茨海默病。考虑到睡眠不足对个人的严重后果以及睡眠剥夺与许多疾病的相互作用,了解睡眠剥夺的细胞和分子后果是很重要的。为此,使用了无偏的空间转录组学来定义睡眠缺失是否对特定的大脑区域有明显的分子影响。
结果
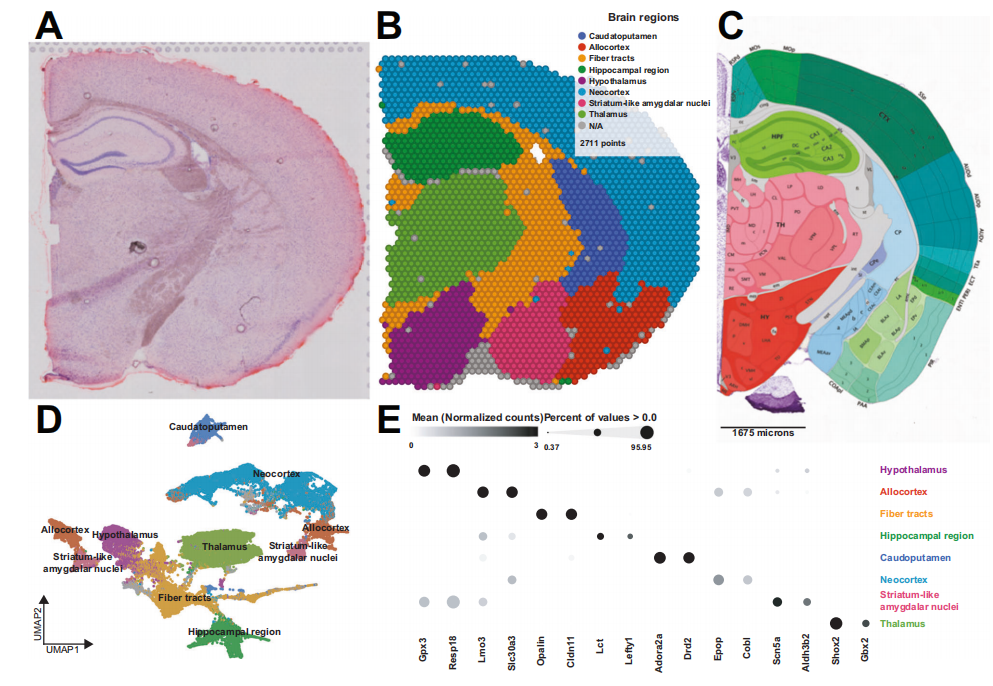
利用空间转录组,分析了睡眠剥夺(SD)或对照(非睡眠剥夺(NSD))成年雄性小鼠冠状脑切片中的空间基因表达。为每种条件下的样本生成区域富集的表达谱,以高可靠性预测了脑区域,并再现了参考Allen小鼠脑图谱中的脑区域。每个大脑区域都具有特定的转录特征,无监督聚类分析显示不同的聚类和标志物。总之,这些结果突出了空间转录组学在小鼠大脑中实现高分辨率表达谱的能力。
研究结果
1. 睡眠剥夺对大脑每个区域的转录活动都有不同的影响
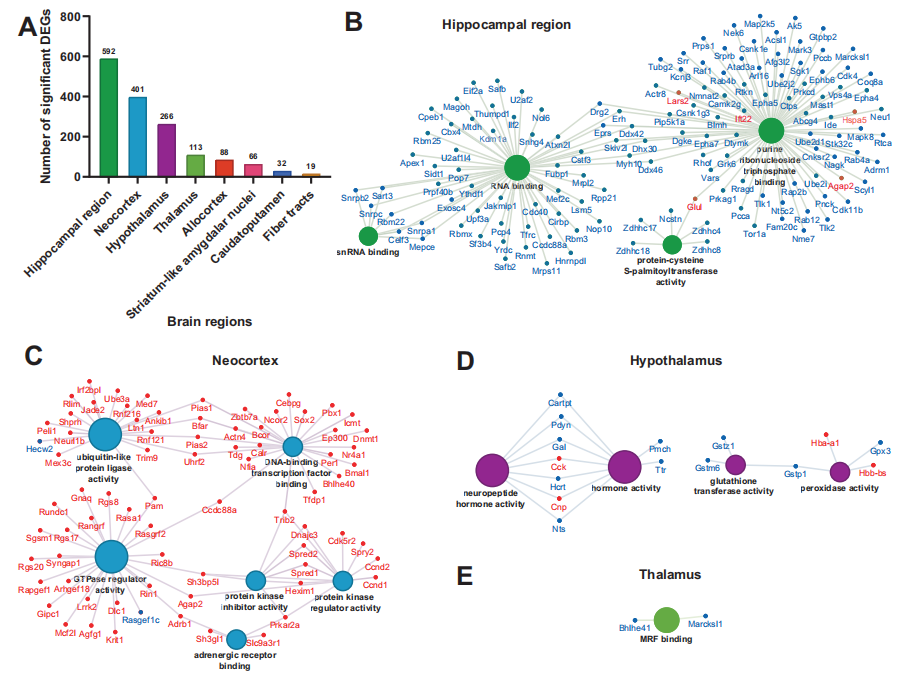
对每个脑区进行了差异基因表达分析。筛选显著差异表达基因(DEGs),发现海马区受睡眠不足影响的显著DEGs最多(592个DEGs),其次是新皮层(401个DEGs)、下丘脑(266个DEGs)和丘脑(113个DEGs)。其中一些DEG,如Rbm3、Hspa5和Srsf5,在之前的海马体和其他大脑区域的研究中,已经被证明在睡眠剥夺后受到影响。
DEGs的分子功能表现出区域特异性的差异。在海马区,许多与RNA加工相关的分子功能富集。对于新皮层,与蛋白激酶活性、GTPase活性、泛素连接酶活性和dna结合转录因子结合相关的分子功能被富集。下丘脑中的deg具有与神经肽和激素活性相关的分子功能,以及谷胱甘肽转移酶和过氧化物酶活性。丘脑中的DEGs富集了肌生成调节因子(MRF)结合的分子功能。令人惊讶的是,海马区~98%的显著下调,而新皮层区~96%的显著上调。
2. 海马体亚区受到睡眠剥夺的不同影响
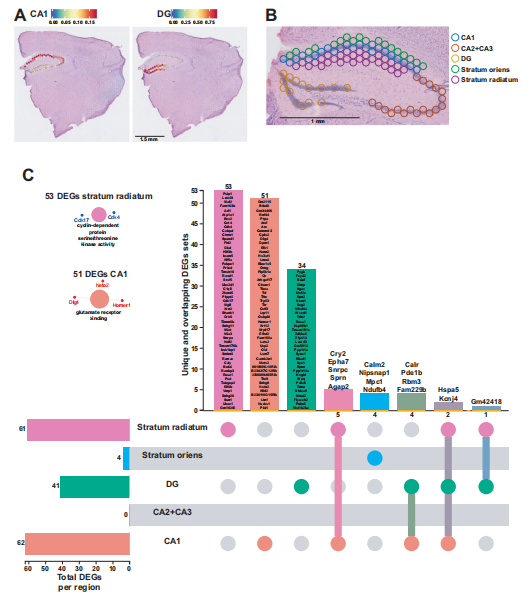
正如本研究和先前的研究表明,海马体非常容易受到急性睡眠剥夺的影响。这个大脑区域由几个亚结构组成,即CA1、CA2、CA3和齿状回(DG)。使用Allen Brain Atlas的scRNA-seq全海马小鼠数据集对CA1锥体层和齿状回(DG)颗粒细胞层进行了去卷积,并能够基于空间位置区分CA2和CA3锥体层区域。对海马各亚区域的差异基因表达分析,CA1锥体层和辐射层受睡眠剥夺的影响最大,所检测区域的DEGs和独特的DEGs最多。辐射层有53个独特的DEGs,富集到周期蛋白依赖的蛋白丝氨酸/苏氨酸激酶活性,而CA1锥体有51个独特的DEGs,富集谷氨酸受体结合。CA2和CA3锥体层中没有显著影响基因。所以,CA1和DG受到睡眠剥夺的影响,而CA3区域的影响较小。
3. 睡眠剥夺会导致大脑皮层中特定层的转录变化
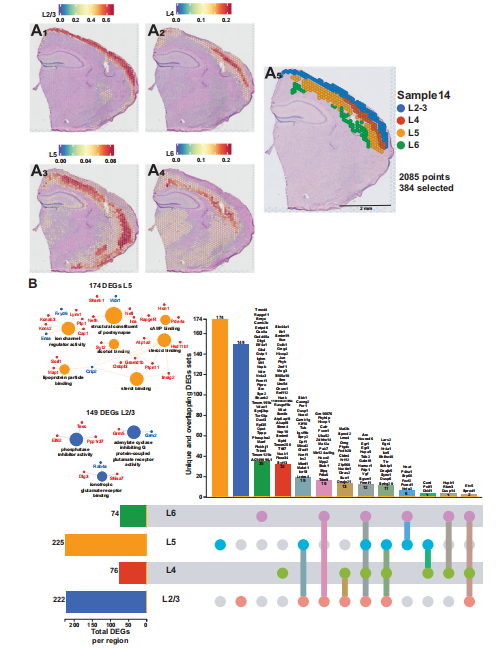
新大脑皮质是受睡眠剥夺的第二大影响,将空间数据集与Allen Brain Atlas的14000个成年小鼠皮质细胞分类学的参考scRNA-seq数据集,对空间数据集进行了反卷积。根据每个点的预测评分来识别新皮层的各个层,并在每一层进行差异基因表达分析。第2/3层和第5层在睡眠剥夺后受转录影响最大,分别有222个和225个显著的DEGs。各皮层的差异基因分析显示,在特定层中,独特地富集不同的差异表达基因和分子功能,这可能与皮层内处理和皮层输出中的差异功能有关。
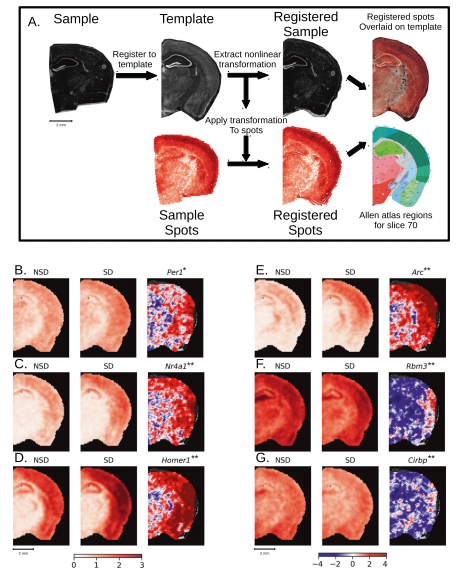
4. 通过空间转录组学分析工具(STAnly)将切片注册到一个共同的解剖参考空间,可以对整个大脑切片的转录组数据进行不受限制的分析
为了解决空间分辨率的损失,建立了一种分析工具:空间转录组学分析--STANLY,该工具将多个样本的点排列到一个共同的解剖参考空间,即艾伦小鼠大脑图谱的共同坐标框架(CCF)中,从而允许在不受限制的推理空间中逐点比较转录组。使用这种方法,在所有样本切片中检测到至少18893个基因在NSD和SD之间的表达变化。其中413个基因显著差异表达,150个基因在所有显著点显示上调,22个基因在全部显著点显示下调,256个基因在整个样本空间中同时出现上调和下调。这些DEG包括先前描述的,新皮层中,Per1、Nr4a1、Homer1和Arc上调,Rbm3和Cirbp下调。显示出海马体特异性变化,与去卷积方法中看到的变化类似。
参考文献:
Vanrobaeys Yann,Peterson Zeru J,Walsh Emily N et al. Spatial transcriptomics reveals unique gene expression changes in different brain regions after sleep deprivation.[J] .Nat Commun, 2023, 14: 7095.
