伴随着免疫学、细胞生物学和病毒学等学科的发展以及细胞制造和基因工程技术的进步使得免疫细胞治疗各疾病的研究取得了令人振奋的进展,该进展也使免疫细胞疗法从研究机构小规模研究的治疗方法一跃成为全球企业开发的焦点。基因工程和临床规模的基因编辑技术的快速发展以及相关药企的投资,使免疫细胞疗法在当今以及未来几十年内对人类健康产生重大的影响。免疫细胞疗法利用患者自身的免疫系统对抗疾病,而免疫细胞(如T细胞、B细胞、NK细胞、巨噬细胞等)的基因工程改造是免疫细胞疗法的先决条件。例如在CAR-T治疗中,患者的T细胞在体外被进行基因改造表达肿瘤相关抗原受体,从而使CAR-T细胞能够在患者体内靶向杀伤特定的癌细胞。
免疫细胞基因编辑技术的关键步骤是需要将细胞外源物质(DNA\RNA\RNP等)导入到细胞内从而实现相关的基因编辑,然而目前该技术的挑战在于使用传统的病毒转染方法存在传统的病毒转染方法存在引起宿主的免疫反应导致疗效降低以及生物安全等问题,而电穿孔转染技术具备无毒性、效率高等特点绕过了传统转染方法的潜在缺陷,因此电转染技术在生物医学研究中得到了广泛应用。做为在细胞转染和融合领域拥有超过二十年的研究经验的NEPA GENE公司来说,其代表产品NEPA21高效基因转染系统自上市以来备受国内外众多用户的青睐。在免疫细胞转染方面,NEPA21均被研究者们用于转染实验中,积累了丰富的转染条件、产品应用等宝贵的经验和数据。以下列举的是近年来科研人员使用NEPA21在免疫细胞转染的部分案例:
案例1 使用NEPA21电转人NK细胞
参考文献:Ng Y Y, Du Z, Zhang X, et al. CXCR4 and anti-BCMA CAR co-modified natural killer cells suppress multiple myeloma progression in a xenograft mouse model[J]. Cancer Gene Therapy, 2022.
转染物质:CXCR4 mRNA
电转参数:穿孔电压240V,脉冲长度2ms,脉冲次数1次
多发性骨髓瘤(Multiple myeloma, MM)是一种以骨髓浆细胞克隆扩增和免疫球蛋白异常积聚为特征的B细胞肿瘤,以溶解性骨病为标志。近年来,嵌合抗原受体(CAR)细胞疗法已成为一种新的治疗MM的方法,而在CAR细胞治疗MM的潜在靶点中,B细胞成熟抗原(BCMA)是一个理想的靶点。目前的BCMA特异性CAR细胞疗法使用来自患者的自体T细胞或NK细胞,而NK细胞转运到骨髓依赖于CXCR4的表达,CXCR4是一种趋化因子受体,与骨髓表达小众的趋化因子CXCL12/SDF-1α结合。
基于此,在该研究中为了产生表达CXCR4的NK细胞,将0.2ml的扩增后的107个NK细胞与10μg CXCR4 mRNA混合,使用NEPA21电转仪在2mm电转杯中进行电转染,下游实验电转染方法也被用于在NK细胞上表达抗BCMA CAR受体。电转染后检测检测CXCR4分子的表达情况,结果显示:模拟NK细胞和经CXCR4WT RNA电穿孔的NK细胞在细胞迁移方面无显著差异(P=0.159,图1C)。进一步证明,CXCR4R334X mRNA和CXCR4WT mRNA的电穿孔不影响NK细胞的细胞溶解功能,并且两种类型的CXCR4修饰的NK细胞能够像模拟电穿孔的NK细胞一样有效地溶解K562细胞(图1D)。接下来,作者也测试了CXCR4r334x修饰的NK细胞会更有效地迁移到NSG小鼠的骨髓腔室(图1E)。结论是体外扩增NK细胞中CXCR4的过表达可有效促进其向骨髓迁移。
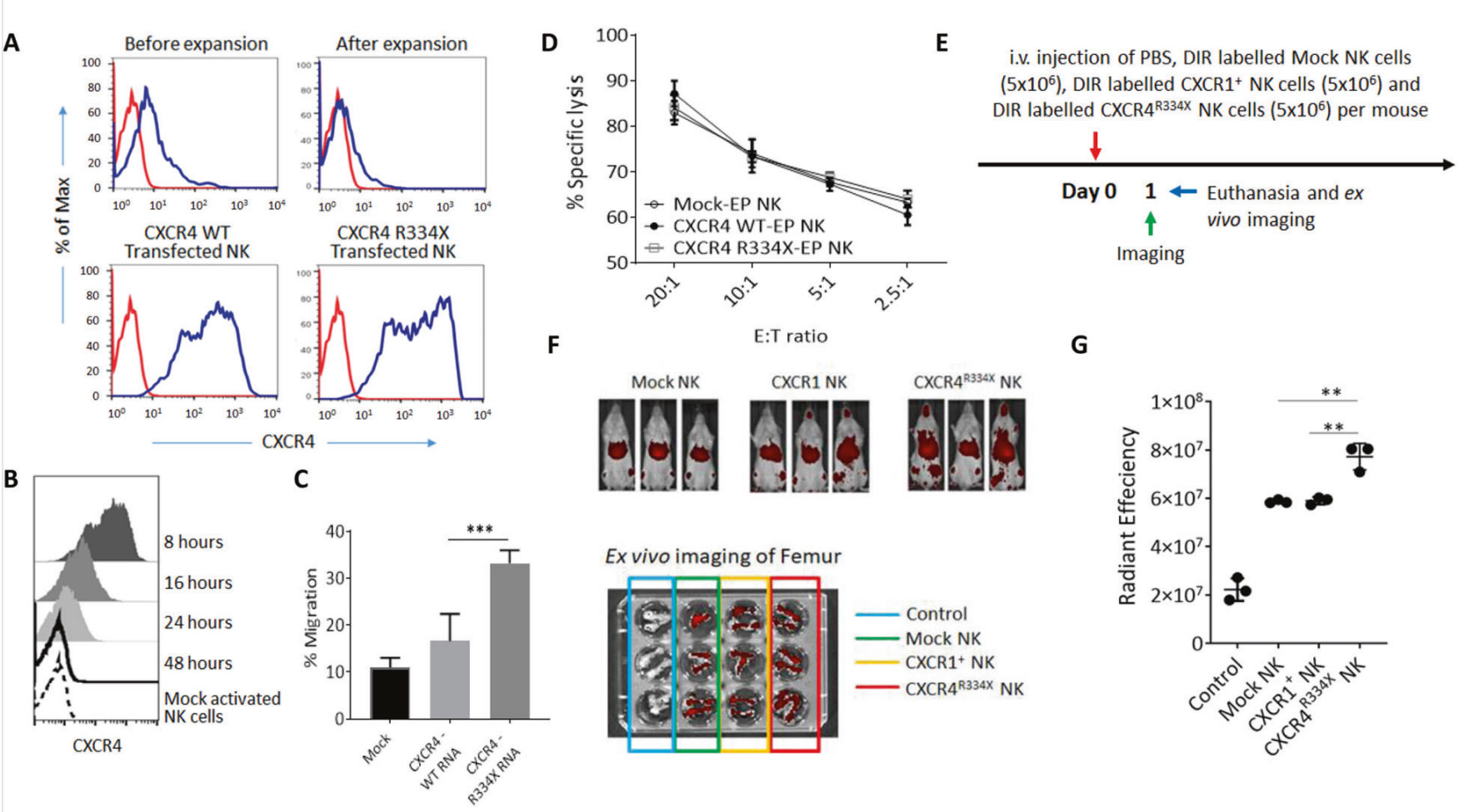
图1.通过mRNA电穿孔过表达CXCR4R334X可提高NK细胞的迁移和归巢能力(A:在NK细胞体外扩增前后,用CXCR4WT mRNA或CXCR4R334X mRNA电穿孔(电穿孔后8h)后,分析CXCR4在NK细胞中的表达D:转染mRNA的NK细胞对K562细胞株的细胞毒性实验,证明电穿孔对NK细胞的细胞毒性没有影响。
在后续电转实验中,作者提到电转后NK细胞的活力70-80%,其中约90%的NK细胞被转染以表达CARs(图2)。

图2.电转后,NK细胞的存活率为70—80%,转染效率为90%
案例2基于CRISPR/cas9的基因编辑法使用NEPA21电转染人的T细胞
参考文献:Ito Y, Inoue S, Nakashima T, et al. Epigenetic profiles guide improved CRISPR/Cas9-mediated gene knockout in human T cells[J]. Nucleic acids research, 2024.
转染物质:RNP复合物
电转参数:穿孔脉冲:电压275V,脉冲时长1ms,脉冲间隔50ms,脉冲2次,衰减率10%,极性+;转移脉冲:电压20V,脉冲时长50ms,脉冲间隔50ms,脉冲5次,衰减率40%,极性+/-。
在免疫细胞过继免疫治疗中,对特定基因进行基因修饰是增强抗肿瘤免疫细胞功能的有效手段。目前CRISPR/Cas9技术的进展使得在体外制备输注的T细胞产品时,可通过瞬时转染RNP实现基因敲除。然而选择最佳的gRNAs仍是有效基因敲除的主要挑战。在本实验中作者利用人类T细胞中CRISPR/Cas9介导的基因敲除的汇总数据探索了一种选择最佳gRNA的方法。作者使用了高通量测序(ATAC-seq)法从转座酶及染色质中获得的培养T细胞的表观遗传谱数据,将表观遗传信息与基于序列的预测工具相结合,显著提高了基因编辑效率(图1)。并且进一步证明,通过在相邻区域设计两个gRNA,可以靶向表观遗传封闭区域。该实验证明了通过IL-7预处理可以提高未活化T细胞的基因编辑效率。这些发现使得在人类T细胞中进行更有效的基因编辑成为可能。
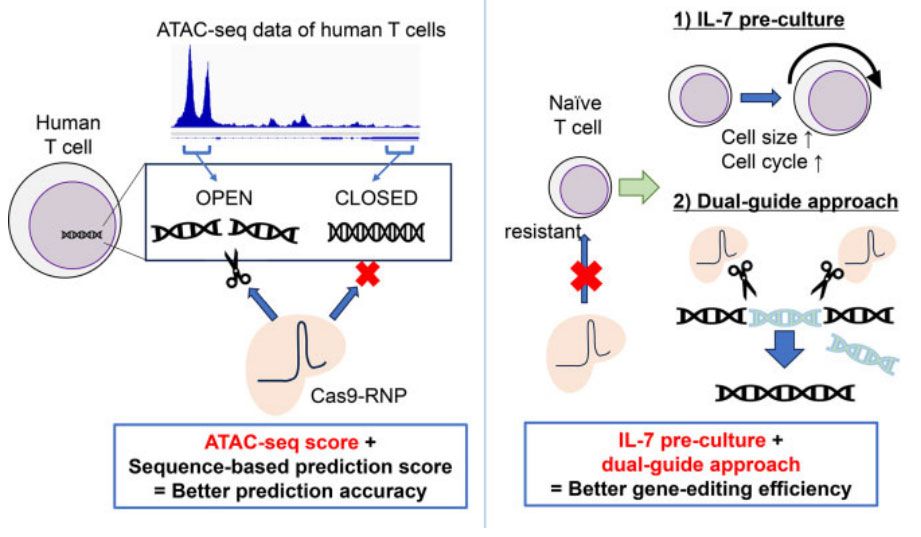
图1.基于ATAC-seq与IL-7的预处理,显著提高T细胞的基因编辑效率。
由于病毒转染方法获得的数据已经构建了许多用于设计gRNA的预测工具,但尚不确定这些发现是否适用于电转染RNP的情况。因此在研究CAR-T细胞的基因工程中,作者利用Cas9-gRNA RNP复合物的瞬态电穿孔来增强其功能,在T细胞激活后5天内,使用NEPA 21电穿孔器(NEPA GENE)将核糖核蛋白复合物(RNP)进行电穿孔到T细胞中。48-72h后,提取基因组DNA,通过PCR扩增含有目标位点的基因组区域,并将扩增子进行Sanger测序。使用CRISPR编辑推断(ICE)分析计算每个gRNA的编辑效率。使用Indel百分比来评估CRISPR/Cas9介导的基因编辑效率(使用TYE 563标记的RNA去判断RNP复合物的转染效果)。采用电转染方法,作者积累了205个gRNA针对110个基因的Indel百分比数据,发现效率在不同的靶位点之间变化很大(图2A)。
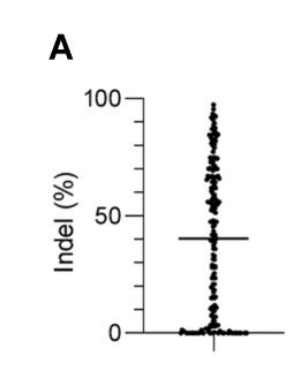
图2A.CRISPR/ cas9介导的人类T细胞基因编辑效率的gRNA设计算法的验证,分别用Cas9-gRNA复合物电穿孔T细胞,分析基因编辑效率(n = 205个靶标)。
采用同样的电穿孔参数,将TET2(图3B)、DOT1L(图3D)和PRDM1(图3F)敲除时可增强T细胞早期记忆表型的维持,并计算Indel百分比。
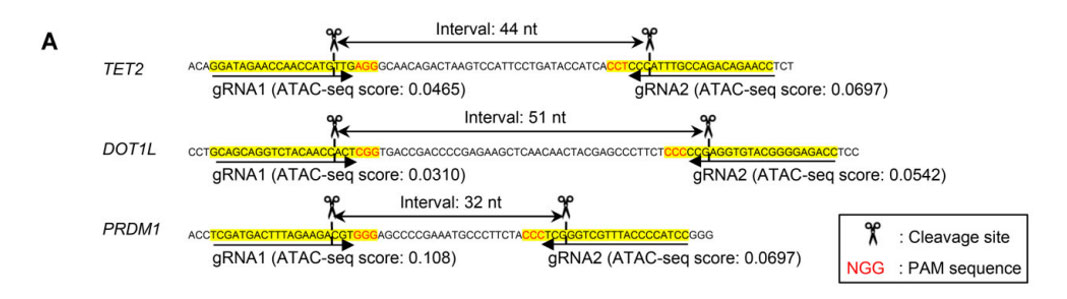
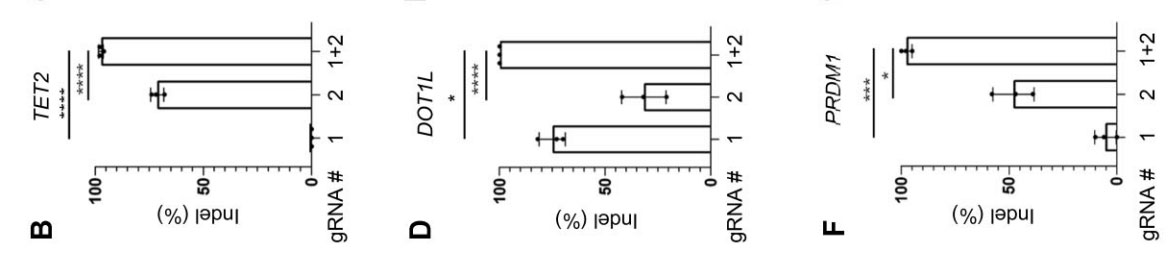
图3.(A)gRNA设计在两个近端区域;两个gRNA单独或联合电穿孔TET2 (B)、DOT1L(D)和PRDM1(F)时,计算Indel百分比
为了研究了组成性表达的Cas9和gRNA是否最终能够切割染色质关闭状态的靶位点,用Cas9和gRNA稳定地电转染人T细胞白血病细胞系Jurkat,这些gRNA靶向9个基因内的表观遗传封闭区和2个基因内的开放区作为阳性对照。观察到Cas9和gRNAs稳定表达的Jurkat细胞的Indel百分比逐渐增加,到第14天达到60 - 100%。这些结果表明,组成型表达的Cas9和gRNA基因敲除受封闭表观遗传状态的阻碍较小。
接下来作者检测了IL-7预培养是否会影响未刺激T细胞的基因编辑效率(图4A)。有趣的是,在所有测试基因中,IL-7处理后,Indel百分比逐渐提高(图4B)。这些结果表明,IL-7预处理可以对未受刺激的T细胞进行遗传修饰,联合使用IL-7预处理和双gRNA靶向进一步提高了未活化T细胞的基因编辑效率(图4B)。增强基因编辑的机制之一可能与RNP复合物有效进入T细胞有关。事实上,IL-7预培养增加了T细胞对荧光染料TYE 563标记的双工RNA的摄取,表明转染效率提高。一般来说,体积小的细胞需要较大的外电场才能实现渗透。Naïve经过IL-7预培养后,T细胞的细胞大小增加,这可能在一定程度上有助于RNP复合物的高效转染。
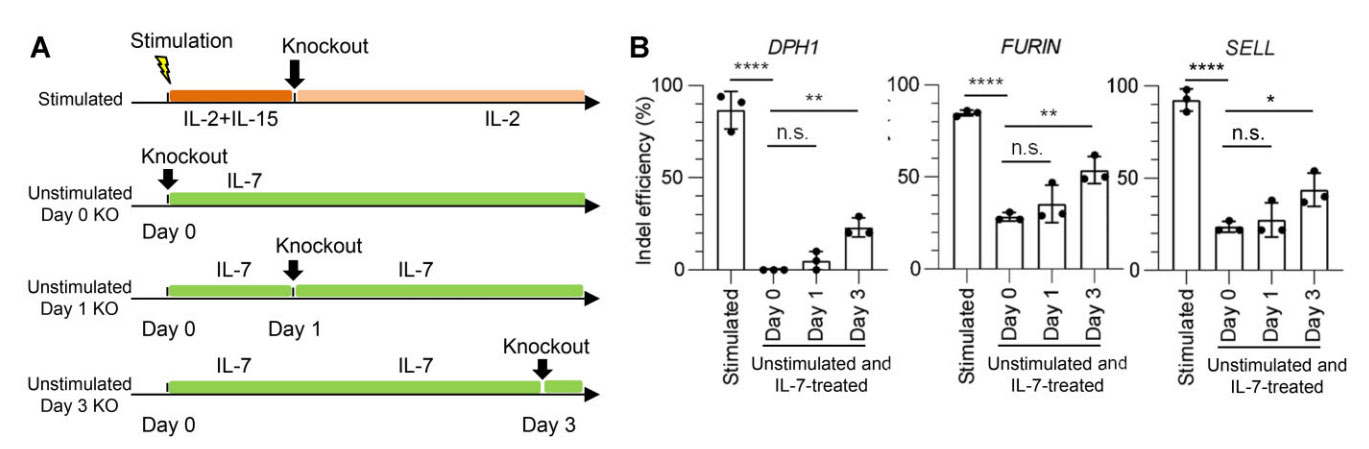
图4.在未激活的T细胞中,IL-7预处理可增强基因编辑效率。(A)电穿孔实验方案示意图。将未激活的T细胞在IL-7的存在下培养,指定的时间段用Cas9/gRNA电穿孔,(B)所示数据为每种情况下靶向DPH1、FURIN和SELL的gRNA的估计指数百分比。
总之,该研究证明了在选择最佳的人T细胞CRISPR/Cas9靶点时需考虑表观遗传谱的重要性,结合ATAC-seq数据和可用的预测工具(利用Cas9/gRNA RNP复合物电穿孔人类T细胞的数据,研究这些工具如何精确地预测靶向效率)支持鉴定有效的gRNA靶标。这些发现为人类T细胞的基因编辑提供了大量有效信息。
案例3使用NEPA21电转染人、小鼠的B细胞
参考文献:David K, Friedlander G, Pellegrino B, et al. CD74 as a regulator of transcription in normal B cells[J]. Cell Reports, 2022.
转染物质:siRNA
电转参数:275V,3ms。
B淋巴细胞通过分泌抗体和细胞因子,并通过其抗原呈递功能启动T细胞介导的免疫反应,在体液免疫反应中起关键作用。CD74是一种II型跨膜蛋白,主要在抗原呈递细胞(APC)上表达,CD74 的配体是巨噬细胞迁移抑制因子(MIF)细胞因子超家族,其与CD74 结合以诱导与CD44 形成复合物。该受体复合物对于启动调节B细胞维持所需的信号级联反应至关重要并涉及PI3K/AKT通路的激活。该复合物被内化到内吞区室,在那里它被切割释放CD74 细胞内结构域片段(CD74-ICD)。CD74-ICD易位至细胞核诱导核因子κB(NF-κB)的p65激活结构域磷酸化,并与其共激活因子一起上调TAp63 表达。该激活通路诱导BCL-2表达水平升高,并导致控制 B 细胞增殖和基因的转录调控。在之前的研究中,科学家已经证实了CD74在慢性淋巴细胞白血病(CLL)细胞中起着转录调节因子的作用,但在B细胞中的功能研究还未有过,因此该研究是很有必要的。
为了研究CD74在B细胞中的功能作者对来源于人和老鼠的正常B细胞进行RNA的提取和逆转录、抗CD74抗体活化B细胞、制备ChIP-seq文库及其序列分析、沉淀抗体加到细胞裂解物中进行免疫沉淀分析、siRNA电转染B细胞、流式细胞染色、模型构建及数据分析等方法(图1)。
图1.CD74在健康与CLL患者的B细胞中转录调节作用对比,揭示了在致癌转化过程中激活或抑制的途径。
其中在电转染实验过程中,作者使用NEPA21电穿孔仪通过电穿孔人和小鼠的B细胞引入siRNA(使用的抑制序列包括:人和老鼠细胞的PAX5;非特异性对照siRNA;图2H、图3A)。
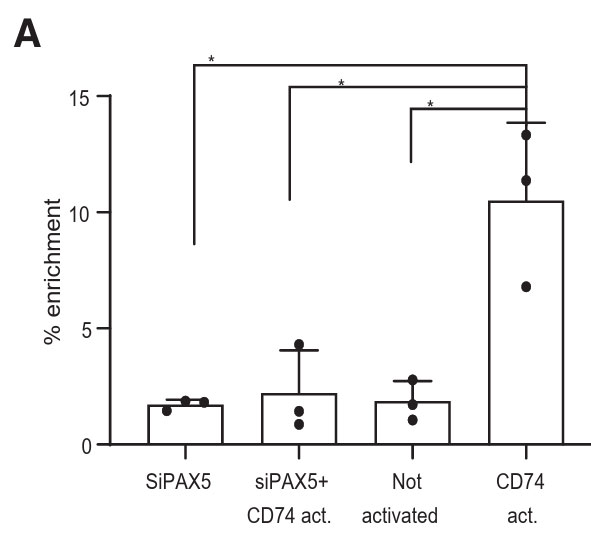
图2H.用PAX5或对照siRNA电转染纯化的健康人B细胞,通过qRT-PCR分析DMTF1的mRNA水平,图表显示了所选基因的倍数变化。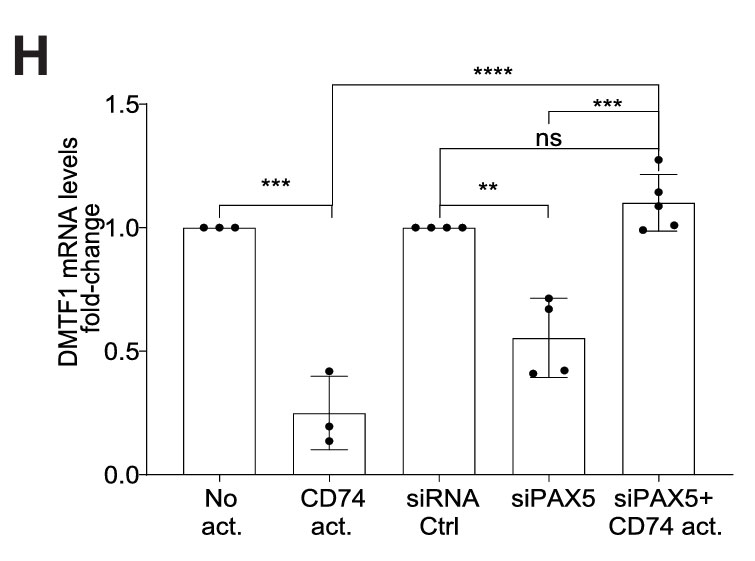
图3.CD74以PAX5 依赖性方式调节 DMTF1转录(A:用siRNA PAX5或siCtrl转染老鼠B细胞,培养后,用载体活化细胞1小时收集细胞并进ChIP,CD74-ICD与DMTF1基因的启动子区域的结合由qPCR确定.Graph表示输入富集百分比。
在本研究中,作者研究了CD74-ICD在正常B细胞中的转录和调控功能。发现激活后CD74-ICD在胞质溶胶中与转录因子(如PAX5)形成复合物,并且与CLL细胞中的结合相比,染色质在位点数量明显增加。这些结合基因主要部分的表达在恶性细胞中被关闭。CD74-ICD:PAX5复合物结合抑癌基因 DMTF1 的启动子区域,并通过抑制转录下调其表达。这些发现可以帮助确定在致癌转化过程中受到调节的新治疗途径,并成为未来治疗的靶点。
总 结
如今随着基于细胞的基因治疗分子工具被开发利用,包括FDA批准的CAR-T免疫疗法、iPSC、细胞重编程和基因编辑等。尽管这些应用取得了很好的结果,但包括核酸和蛋白质在内的等外源分子在细胞内的递送仍然具有挑战性,因此,以脉冲电场电穿孔细胞基因转移具有明显的处理简单、高效、高转染、高存活率以及免疫反应限制低等优势,电穿孔转染技术已成为目前流行的非病毒转染技术之一。电转染技术也在由细胞的基因功能紊乱或突变所引发的诸多疾病(如免疫缺陷病、癌症、帕金森病、阿尔茨海默病等)研究治疗中,通过将质粒或相关基因编辑分子工具引入到细胞内来解读细胞功能、指导细胞命运、重编程细胞行为的重要策略,有望对细胞的正常功能恢复和疾病的治疗做出重要贡献。
NEPA21高效基因转染系统采用全新设计的电转程序,配合专利的电压衰减设计,在获得高转染效率的同时,提高细胞存活率。操作简单,电转参数可见可调,适用性强。特别适用于难转染的原代免疫细胞、干细胞、神经细胞、外泌体、类器官、活体动物、受精卵及宫内胚胎等的转染,已应用于众多著名期刊文献中,是进行细胞悬浮/贴壁状态、活体和离体组织转染的电转系统主流品牌之一。
参考文献
1. Ng Y Y, Du Z, Zhang X, et al. CXCR4 and anti-BCMA CAR co-modified natural killer cells suppress multiple myeloma progression in a xenograft mouse model[J]. Cancer Gene Therapy, 2022, 29(5): 475-483.
2. Ito Y, Inoue S, Nakashima T, et al. Epigenetic profiles guide improved CRISPR/Cas9-mediated gene knockout in human T cells[J]. Nucleic acids research, 2024, 52(1): 141-153.
3. David K, Friedlander G, Pellegrino B, et al. CD74 as a regulator of transcription in normal B cells[J]. Cell Reports, 2022, 41(5).
4. Alinezhadbalalami N, Graybill P M, Imran K M, et al. Generation of tumor-activated T cells using electroporation[J]. Bioelectrochemistry, 2021, 142: 107886.
5. Campelo S N, Huang P H, Buie C R, et al. Recent advancements in electroporation technologies: from bench to clinic[J]. Annual Review of Biomedical Engineering, 2023, 25: 77-100.
6. Heller L C, Heller R. In vivo electroporation for gene therapy[J]. Human gene therapy, 2006, 17(9): 890-897.
您身边的生物制药专业团队
艾贝泰生物科技有限公司(Applitech Biological Technology Co., Ltd.)作为一家集设计、研发、生产、销售和服务于一体的高新技术企业,致力于为生物制药领域提供专业的生产及分析设备、一次性耗材和整体解决方案。从成立至今,我们始终以客户为中心,将“质量为本,服务为先”作为经营方针,立足于生物工艺的优化、放大和生产,不断完善生物制药领域的产品线,为用户提供全方位生物工艺的专业解决方案,助力用户在生物制药领域不断取得新的突破。
