类器官是能够在体外三维培养,并表现出相应器官生物学特征的“最小系统”。虽然许多类器官的培养方案日渐成熟,但在实际操作中总会碰到这样那样的问题,今天小编整理了一些类器官培养操作中常遇到的问题,希望能够对各位小伙伴有所帮助。
Q1: 按照文献方法进行类器官培养,为什么观察到的形态却和文献不一致?
A1:决定类器官形态的因素有很多,样本来源是否相同、选用的细胞因子品质是否有差异都有可能改变最终的类器官形态。这里举一个文献中的例子,分别取四个高级别浆液性(HGS)卵巢癌患者的肿瘤组织,用同样的条件进行类器官培养,H&E染色结果显示它们的形态千差万别【1】。因此对于类器官的鉴定,我们不能局限于形态观察,需要使用多种方法相结合。
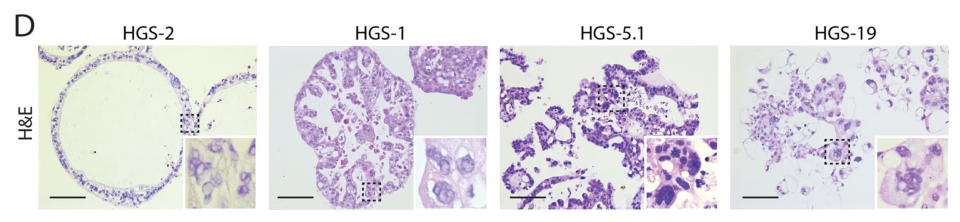
图1. 由4例HGS卵巢癌患者的肿瘤组织所制备的类器官形态不同【1】
Q2:类器官的药敏实验中需要使用DMSO作为药物的溶剂,需要控制DMSO的用量吗?
A2:考虑到DMSO这类有机物的细胞毒性,建议终浓度不超过0.1%(v/v)。
Q3:培养过程中发现类器官培养物中有黑色小颗粒,这个是杂质吗?应该怎样去除?
A3:黑色小颗粒大概率是杂质或细胞碎片,去除它们有以下两种方式可以参考:
1、将类器官消化下来,用培养基进行反复清洗,达到稀释杂质的作用;
2、用无菌手术刀将类器官切成两半,取1ml注射器吸满培养基并轻轻推出,冲洗类器官中的杂质【2】。
Q4:对于肿瘤患者的个性化医疗测试,PDO、PDX、PDXO的模型可以相互结合使用吗?
A4:PDO、PDX、PDXO模型有各自的优势,通常有以下两种结合方式:PDO-PDX和PDX-PDXO。
1、PDO-PDX是性价比更高的方式,即:先利用PDO进行高通量的药物筛选,筛选出有效的药物再进行PDX测试。
2、PDX-PDXO是更精准的药物测试方式,即:先利用PDX产生大量的体内肿瘤,然后将这些肿瘤分离进行PDXO培养,此时可以通过PDX模型,将PDXO的药敏实验结果与体内用药结果一一对应,进而预测人体用药的结果,实现对患者更精准的用药指导;并且可以用PDX模型将转移后的肿瘤分离,同样进行PDXO培养和用药,能够更精确地对转移灶进行药物筛选。
Q5:类器官怎么从基质胶中回收?
A5:1、将类器官放置在冰上,待基质胶融化后离心进行回收,这种方式适用于不需要将类器官结构完全打散的情况;
2、市售的细胞回收液,可以温和有效地获得细胞悬液,不会损伤细胞或细胞表面蛋白。
Q6:为什么用基质胶来培养类器官?可以用其它类型的凝胶替代吗?
A6:基质胶能够为类器官提供支撑作用,目前类器官培养用的基质胶来源于小鼠肉瘤的基底膜基质,其中含有约60%层粘连蛋白、30% IV 胶原和8%的巢蛋白,还含有基底膜聚糖、TGF-ß、表皮生长因子、类胰岛素生长因子、组织纤溶酶原等1800多种独特的蛋白质。由于基质胶中各因子的不确定性,并且存在批次间差异,因此目前也有一些聚焦于基质胶替代方案的研究,如图2【3】。
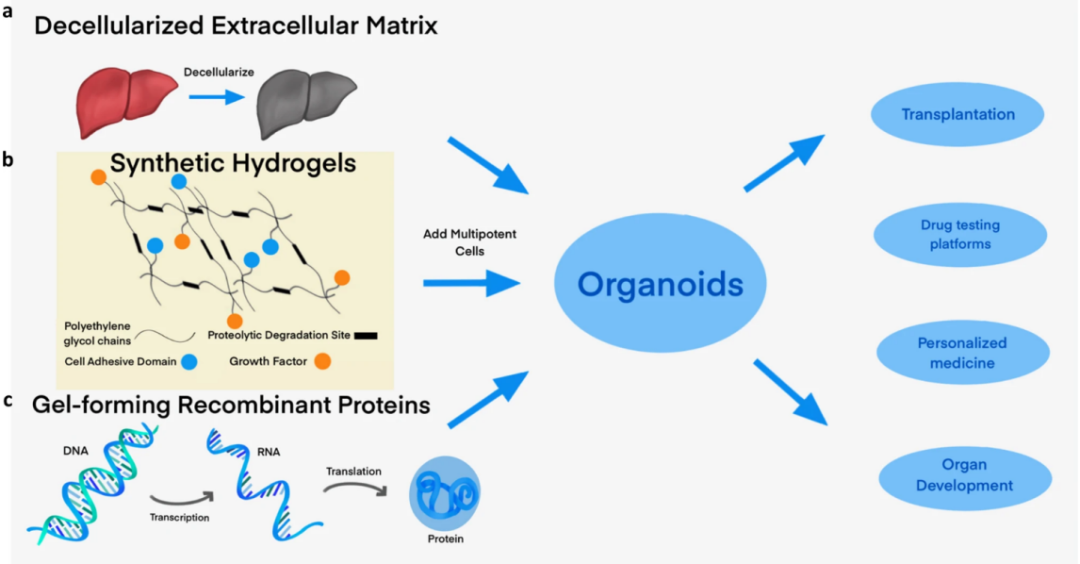
图2.基质胶的三种替代方案【3】。(a)去细胞外基质和其他衍生蛋白质,(b)合成水凝胶,以及(c)工程重组蛋白凝胶
Q7:怎样确定某一种类器官的培养方式更适用于基质胶包埋法还是气-液交互法呢?
A7:1、根据所模拟的器官自身生长情况选择,例如:皮肤的正常生长是有一面需要接触空气,那么对于皮肤类器官的培养倾向于利用气-液交互法来培养【4】;
2、考虑所培养的类器官模型的应用方向,例如:气-液交互法培养易于进行病毒感染实验,因此用于病毒感染实验的气道类器官会优先选择气-液交互法培养【5】。
Q8:在进行药敏实验前,类器官的接种方式是怎样的呢?
A8:药物筛选前,通常将类器官吹散后,用含2%-5%基质胶的培养基悬浮,并最终铺在基质胶包被的孔板中【6-7】。
Q9:在离心回收时,会有很多类器官粘附在离心管壁,有没有更好的办法提高回收率?
A9:建议采用水平转子代替角转子,可以有效减少类器官挂在离心管壁的情况。
Q10:利用肿瘤类器官模型进行筛选的药物有什么局限性吗?
A10:1、抗体药物因为需要免疫细胞的参与,因此肿瘤类器官不能筛选抗体类药物,此类药物筛选需要构建肿瘤类器官-肿瘤微环境的模型来实现;
2、由于肿瘤类器官中没有对血管进行培养,因此抗血管类的药物也同样不能进行筛选。
以上就是小编总结的类器官应用相关的10个问题,各位小伙伴还遇到过其它的问题吗?欢迎大家在留言区提问,小编会一一回答您们的问题哦!此外,欢迎各位扫码添加近岸小助手二维码,加入类器官培养交流群,在这里会有专业的技术支持人员帮您解惑答疑,也将定期分享类器官前沿进展,让类器官培养更简单!

近岸蛋白自主研发生产的低内毒素Activin A、FGF系列、HGF、R-Spondin 1、Noggin和Wnt3a等细胞因子,内毒素低至<10EU/mg,具有高活性、高纯度、高批间一致性,为类器官培养设计,已获得市场认可,让您研究放心!
推荐产品
|
目录号 |
产品名称 |
|
Human/Mouse/Rat Activin A |
|
|
Human/Mouse/Rat BDNF |
|
|
Human/Mouse/Rat BMP-2 |
|
|
Human DKK1 (N-8His) |
|
|
Human EGF |
|
|
Mouse EGF (C-6His) |
|
|
Human FGF basic/FGF-2 |
|
|
Mouse FGF basic/FGF-2 |
|
|
Human FGF-4 |
|
|
Mouse FGF-4 |
|
|
Human FGF-7/KGF |
|
|
Human FGF-9 |
|
|
Mouse FGF-9 (N-6His) |
|
|
Human FGF-10 |
|
|
Human FGF-19 |
|
|
Human GDNF |
|
|
Human HGF (C-6His) |
|
|
Mouse HGF (C-6His) |
|
|
Human LIF |
|
|
Mouse LIF |
|
|
Human Noggin |
|
|
Mouse Noggin(C-6His) |
|
|
Human NRG1-beta 1 |
|
|
Human NT-3 |
|
|
Human OSM (N-6His) |
|
|
Human Prolactin/PRL |
|
|
Human R-Spondin 1 (C-6His) |
|
|
Human R-spondin 3 (C-6His) |
|
|
Human Shh |
|
|
Human Shh (C24II) |
|
|
Mouse Shh |
|
|
Mouse Shh(C25II) |
|
|
Human TGF-beta 1 |
|
|
Human Wnt3a |
|
|
Human Wnt3a V2 |
参考文献
【1】Kopper, O. et al. (2019). An organoid platform for ovarian cancer captures intra-and interpatient heterogeneity. Nature medicine, 25(5), 838-849.
【2】MILLER, Alyssa J., et al. Generation of lung organoids from human pluripotent stem cells in vitro. Nature protocols, 2019, 14.2: 518-540.
【3】Kozlowski, M. T. et al. (2021). Towards organoid culture without Matrigel. Communications biology, 4(1), 1-15.
【4】Gangatirkar, P. et al. (2007). Establishment of 3D organotypic cultures using human neonatal epidermal cells. Nature protocols, 2(1), 178-186.
【5】Mulay, A. et al. (2021). SARS-CoV-2 infection of primary human lung epithelium for COVID-19 modeling and drug discovery. Cell reports, 35(5), 109055.
【6】Van de Wetering, M. et al. (2015). Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell, 161(4), 933-945.
【7】Hirt, C. K. et al. (2022). Drug screening and genome editing in human pancreatic cancer organoids identifies drug-gene interactions and candidates for off-label therapy. Cell genomics, 2(2), 100095.
