过继性细胞免疫治疗(ACT)在血液瘤治疗中成效显著,但面对实体瘤时效果有限,需创新策略。利用iPSC和基因编辑技术,新型iTNK细胞结合了T细胞和NK细胞的优势,展现出对晚期实体瘤的潜在疗效且具有安全性。然而,iTNK细胞数量稀少,限制了其临床应用。近日,北京大学邓宏魁团队在Cell Reports Methods上发表了题为“Generation of dual-attribute iTNK cells from hPSCs for cancer immunotherapy”的高水平论文。该研究首次公开了由hPSC诱导生成双属性T-NK(iTNK)细胞的方法,并验证该种细胞对多种肿瘤细胞谱系均有显著抑制生长作用,解决了大规模生产临床级的双属性细胞的技术限制,为免疫细胞广泛应用于癌症治疗提供了新策略。 小编整理了该论文中hPSC诱导生成iTNK细胞的Protocol,供广大科研工作者参考。
小编整理了该论文中hPSC诱导生成iTNK细胞的Protocol,供广大科研工作者参考。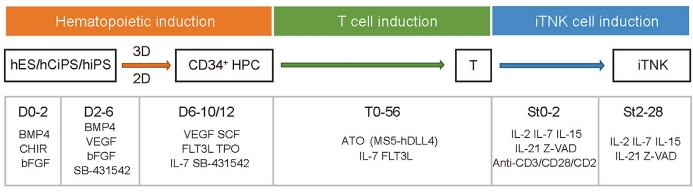 图1 hPSC诱导生成双属性T-NK(iTNK)流程简图[1]
图1 hPSC诱导生成双属性T-NK(iTNK)流程简图[1]
hPSC诱导生成iTNK细胞各阶段培养基试剂配方
表1 hPSC诱导生成双属性T-NK(iTNK)细胞分化培养基组分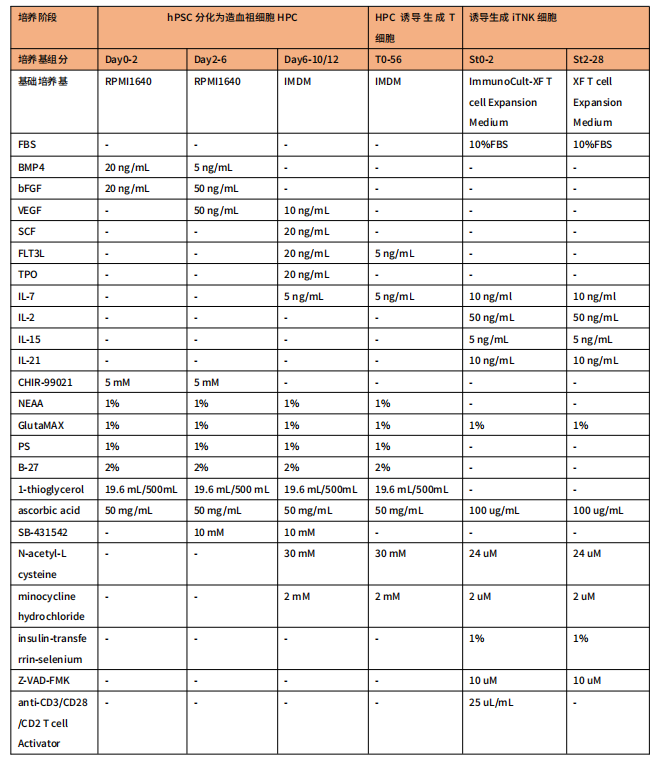 此表格根据文章内容绘制
此表格根据文章内容绘制
由hPSC分化为HPC
在3D培养分化系统中,hPSC先在mTesR Plus培养基中培养,分化前一天,将每孔2×105个细胞接种在6孔超低吸附板中。
-
分化第0天,将培养基更换为含有20 ng/mL BMP4、20 ng/mL bFGF的RPMI1640完全培养基(详细组分详情见表1)。
-
分化第 2 天和第 4 天,将培养基更换为含有 5 ng/mL BMP4、50 ng/mL VEGF、50 ng/mL bFGF的RPMI1640完全培养基中(详细组分详情见表1)。
-
分化第6天和第8天,将培养基更换为含有 10 ng/mL VEGF、20 ng/mL SCF、20 ng/mL FLT3L、20 ng/mL TPO、5 ng/mL IL-7的IMDM完全培养基中(详细组分详情见表1)。
-
在分化第10天,用Accutase解离细胞团,制备单细胞悬液,分选出CD34+ HPC细胞。
HPC-ATO-T细胞分化系统
-
在胸腺中产生T细胞的过程极为复杂,目前,人工胸腺类器官(artificial thymic organoid, ATO) T细胞分化系统是体外产生成熟T细胞最有效的方法。取hPSC分化得到的1×104个HPC与1×105个MS5-hDLL4饲养层细胞重悬于6 mL含有5 ng/mL FLT3L、5 ng/mL IL-7的 IMDM 培养基中,混匀(详细组分详情见表1);然后,将上述混合细胞悬液接种于Transwell上分化培养 8 周。
诱导T细胞生成iTNK
-
收获 ATO 衍生的细胞,机械吹打消化成细胞悬液,2000 rpm离心 3 分钟,重悬于10% FBS、50 ng/mL IL-2、10 ng/mL IL-7、5 ng/mL IL-15、10 ng/mL IL-21、anti-CD3/CD28/CD2 T 细胞激活剂(25 uL/mL)的T 细胞扩增完全培养基(详细组分详情见表1)。
-
将以上细胞悬液接种于24 孔透明平底超低吸附板中培养2 天后,于T细胞扩增完全培养基(不含anti-CD3/CD28/CD2 T细胞激活剂,详细组分详情见表1)培养4周,得到iTNK细胞。
总之,hPSC来源的iTNK为癌症免疫治疗提供了新的方向,该项研究为iTNK在癌症临床试验的应用建立起了稳健的细胞获取方法,为大规模获得临床级iTNK铺平了道路,是创新肿瘤免疫疗法中的重要参考。
