溶瘤病毒(OV)介导的基因治疗是一种重要的新兴癌症治疗策略[1],研究表明,OVs感染的癌细胞会分泌大量细胞因子,而被裂解的肿瘤细胞会释放多种肿瘤相关抗原。溶瘤病毒治疗不仅可以触发免疫应答,而且可以改变肿瘤微环境,促进化疗和放疗的效果,提高免疫检查点抑制剂治疗和免疫细胞治疗的疗效[2]。
溶瘤腺病毒(OAVs)作为携带抗癌基因的载体,可以在癌细胞内严格启动病毒复制,进而实现高拷贝扩增和高效表达抗癌基因,从而实现病毒复制溶瘤和基因表达抑瘤的双重抑癌作用而不影响正常细胞。然而,OAV的靶向肿瘤特异性和抗癌作用在实践中尚未达到预期,单独使用OVs治疗的临床结果仍不能令人满意。
近期,海军军医大学苏长青团队与复旦大学华山医院钦伦秀团队合作在Journal for ImmunoTherapy of Cancer杂志上发表题为Triple-serotype chimeric oncolytic adenovirus exerts multiple synergistic mechanisms against solid tumors的研究论文,苏英晗博士和黎江博士为该文共同一作。研究团队设计具有多种协同抗癌活性的嵌合OAV(OncoViron),文章详细阐述了三血清型嵌合溶瘤腺病毒对实体肿瘤发挥多种协同机制[3]。
OncoViron是一款多重机制协同和增效免疫治疗的嵌合型广谱溶瘤腺病毒,具有三重肿瘤靶向调控机制、三个病毒结构基因改造、三种血清型腺病毒嵌合、三类抗癌免疫基因装载的特点。OncoViron优势:(1)针对癌细胞的病毒复制在转录水平和翻译水平上都有精确的调控;(2)多个病毒结构蛋白的固有抗癌活性被激活;(3)感染癌细胞的能力增强,保证病毒本身不被已有的中和抗体拦截及肝细胞吸附;(4)武装三种抗癌免疫调节基因,增强杀死癌细胞的效果。

结果
01 OncoViron具有较高的肿瘤选择性复制活性
研究人员设计的OncoViron选择肿瘤特异性启动子对肿瘤细胞选择性复制,ODD元件作为基因开关在翻译水平上限制正常细胞中的病毒复制。Ad5/Ad11纤毛嵌合病毒Ad5SVPF11及所有携带单、双或三种细胞因子的病毒均能在各种实体肿瘤细胞中高拷贝复制。体外细胞实验结果表明,OncoViron在包括肝癌、乳腺癌、胆囊癌、肺癌等多数实体瘤细胞系中呈高拷贝增殖,而在正常细胞系中增殖活性较低 (图1)。

图1 OncoViron肿瘤细胞特异性的增殖复制
02 纤毛Ad5F11与六邻体Ad5H48的嵌合增强OncoViron的感染性
柯萨奇病毒腺病毒受体(CAR)是Ad5的受体,对缺乏CAR的骨髓造血细胞、造血干细胞、树突状细胞、部分肿瘤细胞尤其是肿瘤干细胞等感染效率很低。B组腺病毒则主要识别一种广泛表达的补体调节蛋白CD46。采用B组腺病毒的纤毛蛋白(fiber knob)替代Ad5纤毛蛋白,Ad5纤毛与Ad11纤毛嵌合形成嵌合纤毛蛋白Ad5F11来构建嵌合病毒,使之增加识别CD46受体的能力,有利于提高病毒对肿瘤细胞感染效率。
流式细胞术(FCM)发现,在大多数癌细胞株中,CD46的表达水平高于CAR(图2A),而Ad5F11嵌合病毒Ad5SVPF11H48-DsRed在大多数癌细胞株中的感染性明显强于Ad5纤毛病毒Ad5SVPH48-EGFP。Ad5F11嵌合显著增强了OAV在大多数癌细胞中的感染能力。
Ad5在自然界存在较广,大多数人已被感染并产生了中和抗体,能够拦截相同血清型的病毒,研究人员将腺病毒外壳蛋白Hexon的高变区(HVR)与稀有血清型如Ad48腺病毒的Hexon相应区域进行嵌合,动物实验表明Ad5H48嵌合使OncoViron能逃避已有的免疫中和抗体的拦截,肝细胞对OncoViron的粘附和感染也显著减少(图2)。
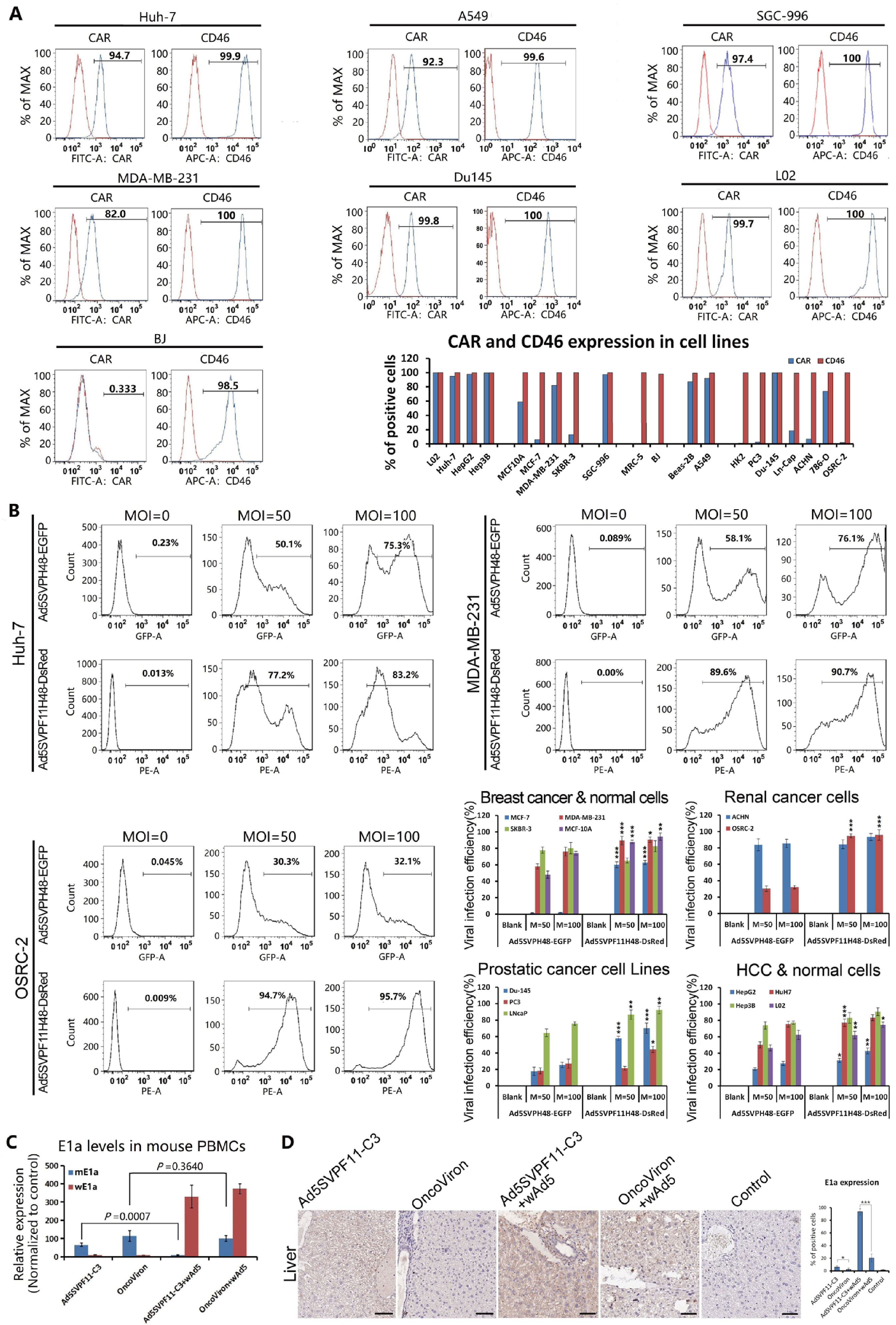
图2 纤毛Ad5F11与六邻体Ad5H48嵌合增强OncoViron的感染性
03 OncoViron介导抗癌细胞因子的高表达且影响肿瘤细胞的转录表达谱
研究人员以MOI=5pfu/cell的感染强度加入OncoViron进行细胞感染,继续培养24h、48h、72h后,收集上清,通过ELISA方法检测IL‑12、IFN‑γ、CCL5基因蛋白表达情况。结果发现,OncoViron能够介导IFN‑γ、IL‑12、CCL5蛋白高效表达,并且随时间延长表达量逐渐增高。
进一步研究OncoViron对细胞转录表达谱的影响,发现差异表达基因(DEGs)主要富集于细胞过程的局灶黏附和吞噬体的功能,以及PI3K-Akt、细胞因子-细胞因子受体相互作用和MAPK通路(图3)。
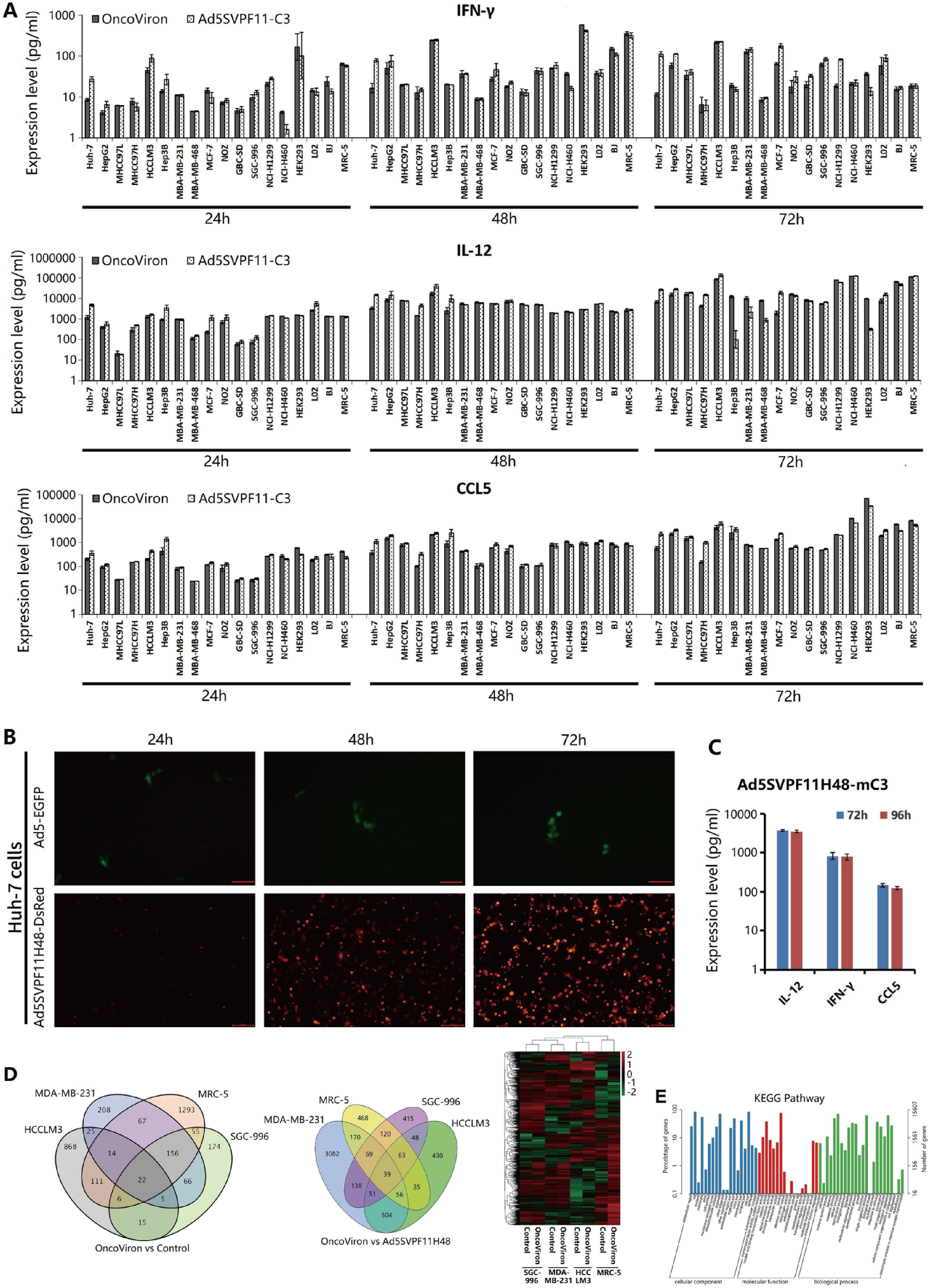
图3 OncoViron介导抗癌细胞因子的高表达且影响细胞转录谱
04 OncoViron诱导肿瘤选择性杀伤活性
实时细胞分析表明OncoViron对各种实体肿瘤细胞系均有显著的细胞毒作用,且呈剂量效应和时间效应关系。在大多数癌细胞系中,三种血清型腺病毒嵌合的OncoViron比两种血清型腺病毒嵌合的Ad5SVPF11-C3表现出更强的溶瘤活性(图4)。
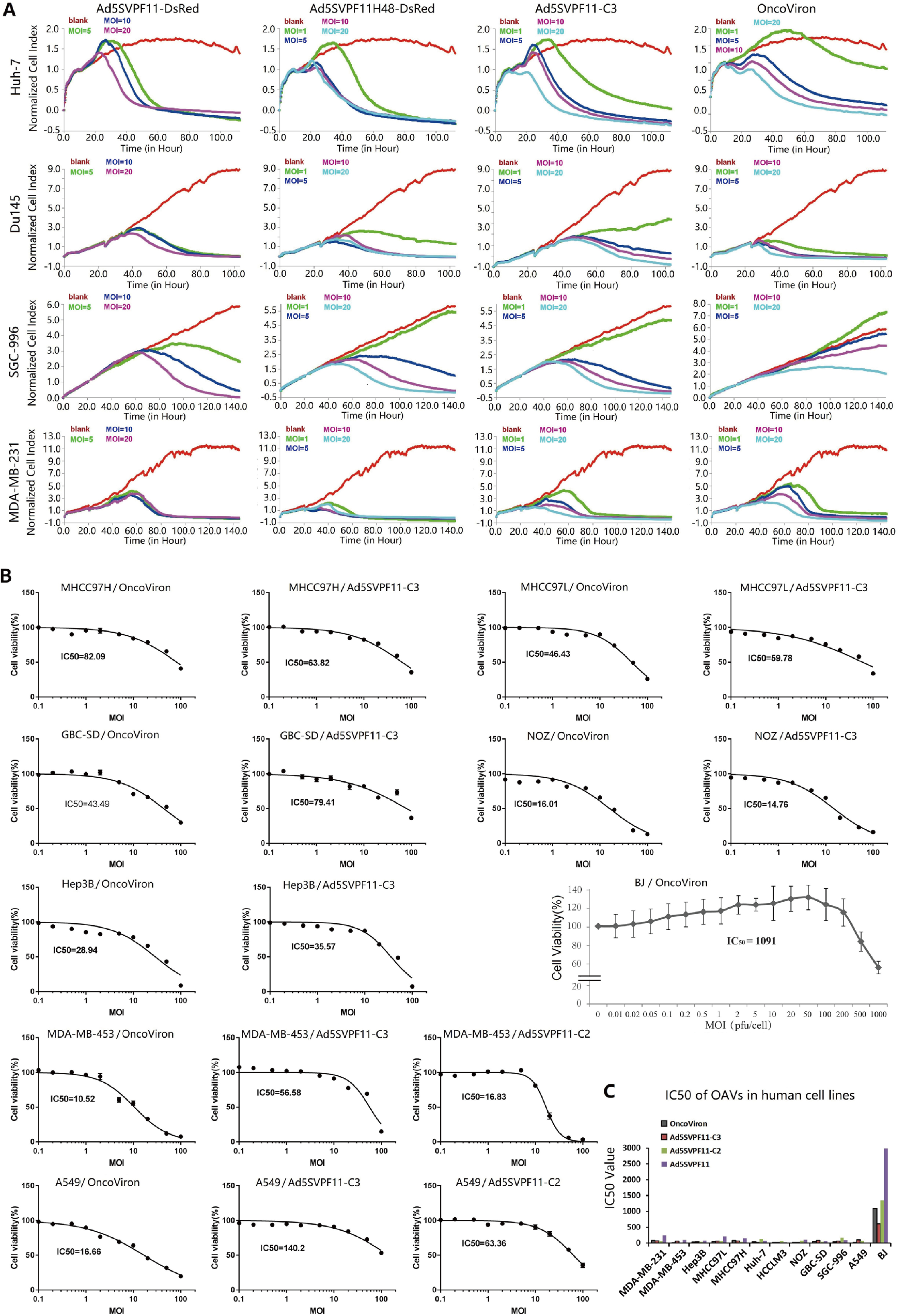
05 OncoViron在肿瘤动物模型中发挥抗癌作用
OncoViron对多种实体肿瘤具有良好的抗癌活性,通过对小鼠移植瘤模型瘤内注射实验表明,OncoViron治疗不仅肿瘤细胞增殖活性下降,而且浸润免疫细胞数量增加,表明肿瘤免疫微环境发生了明显改变(图5)。

图5 OncoViron在肿瘤模型中发挥抗癌作用
06 OncoViron联合免疫治疗可协同抑制肿瘤生长
研究人员用C57-hPD1人源化小鼠接种结肠癌细胞MC38,构建移植瘤模型检测PD-1抗体,单药和联合用药动物实验证实OncoViron与PD-1抑制剂Keytruda联合用药具有协同增效的作用。免疫组化显示,在OncoViron分布和表达mE1a的同一区域,肿瘤组织大面积坏死,伴有淋巴细胞、单核巨噬细胞、树突状细胞(DCs)、成纤维细胞聚集,形成TME中的第三淋巴样结构,对癌细胞起到原位协同杀伤作用,从而增强免疫治疗的疗效(图6)。

图6 OncoViron联合PD-1抗体对移植瘤模型具有协同抗癌作用
作者进一步构建CAR‑T细胞,同时构建不同肿瘤动物模型进行单药和联合用药治疗,结果表明OncoViron确实能够促进CAR-T细胞的增殖和浸润,形成一种协同机制,显著提高治疗效果(图7)。
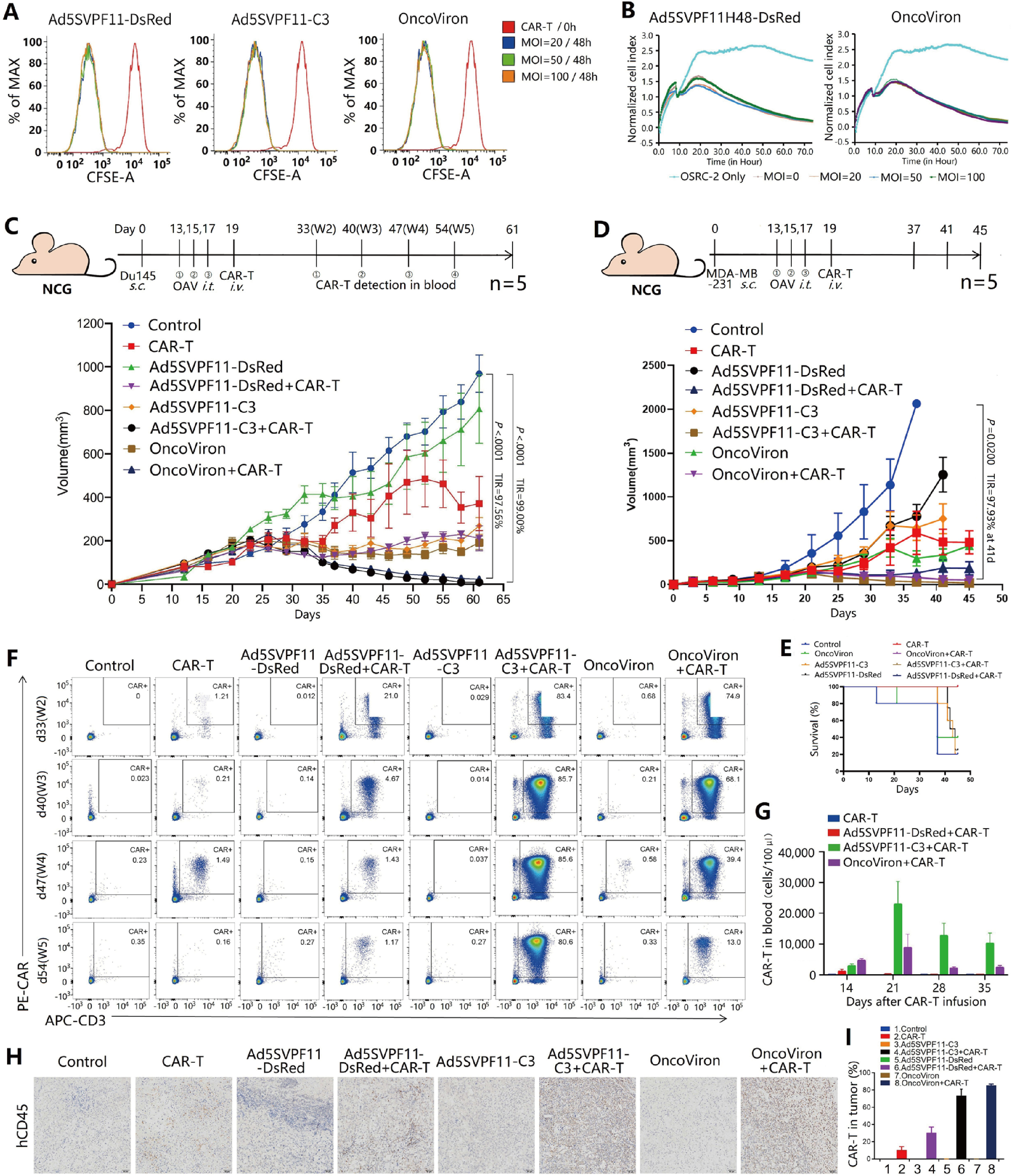
图7 OncoViron联合CAR–T对移植瘤模型具有协同抗癌作用
结论
本文研究发现OncoViron的选择性复制介导抗癌因子的高表达,特异性靶向多种实体肿瘤,显著抑制癌细胞增殖。在免疫缺陷小鼠、免疫增强小鼠和人源化小鼠的多种植入实体肿瘤模型上,OncoViron自身以及与程序性死亡1 (PD-1)抗体和嵌合抗原受体(CAR)T细胞联合显示了巨大的抗癌作用。OncoViron显著改变了受感染癌细胞的基因表达谱,不仅招募大量淋巴细胞、自然杀伤细胞和单核巨噬细胞进入肿瘤微环境(TME),并激活免疫细胞,特别是T细胞,且诱导巨噬细胞M1极化并促进更多免疫细胞因子的释放,从而重塑TME以配合PD-1抗体或CAR-T治疗。嵌合OncoViron是一种新型广谱抗癌产品,具有多种协同和增强免疫治疗机制,为联合免疫治疗实体肿瘤创造了良好的机会。
和元生物有幸为本研究提供病毒包装服务,用实际行动助力肿瘤研究!
参考文献:
[1] Heidbuechel JPW, Engeland CE. Oncolytic viruses encoding bispecific T cell engagers:a blueprint for emerging immunovirotherapies.J Hematol Oncol 2021;14:63.
[2] Nishio N, Dotti G. Oncolytic virus expressing RANTES and IL-15 enhances function of CAR-modified T cells in solid tumors. Oncoimmunology 2015;4:e988098.
[3] Yinghan Su, Jiang Li.,et al. Triple-serotype chimeric oncolytic adenovirus exerts multiple synergistic mechanisms against solid tumors.J Immunother Cancer.2022 May;10(5):e004691.doi: 10.1136/jitc-2022-004691.
