【干货】万里挑到一,药效学研究在药物上市前做了什么?
新药从设计到上市通常需要10-15年的时间,经历漫长的研发过程和层层考验,同时需要大量的资本投入。药物通过发现筛选、临床前研究、临床试验、新药NMPA/FDA上市申报等环节,最终成为稳定、安全、有效的药品,惠及人类健康。其中的每个研究阶段都至关重要,特别是临床前药物研究获得的结果对药物进入临床提供关键的数据指导,为优化临床开发计划提供有力的数据基础。
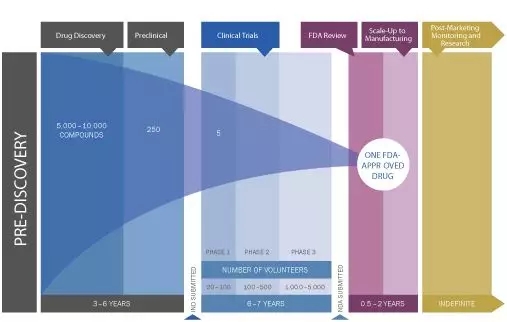
Drug discovery and development[1]
临床前研究-药效学研究
临床前研究涵盖药效学研究、药代动力学研究、药理学评价、毒理安全性评价等。
药效学研究是药物评估的前提基础,用于:确定受试药物有无疗效、鉴别合适的有效及安全剂量方案、阐明受试药物的作用特点、揭示可能的作用机制、药物浓度与药理作用/副作用间的关系;也可以补足指导临床用药,必要时证明药物联合应用的合理性[2-3]。
药效学研究数据在申报的材料准备中,其重要性往往被忽视,大家似乎更关注毒理安全性评价等环节,其原因在于多数风险由申报企业自己承担,实际上临床前体内、体外的药效学除了能为临床给药提供必须的指导外,其研究结果准确性也是一个新药是否能够成功上市,能否收回成本获取利润的关键!
药效学研究主要实验内容包括:体外试验(生化试验、细胞试验等)和体内试验(整体动物实验)。
体内药效试验涉及:
1、动物模型选择:要考虑与临床相关性:动物敏感性,疾病模型发病机制等。
2、药物剂量设置:参考体外试验结果,同类药物有效剂量,预实验结果等设置给药剂量,开始给药时间、给药间隔时间。能否获得有效剂量范围,包括起始剂量、最佳有效剂量和量效关系是判断剂量设置合理与否的标准。
3、给药途径选择:与临床拟给药方式一致,不同的给药途径获得的药效结果也会不同。根据文献及实际体内试验发现联合用药的给药先后顺序对结果也有重要影响,体外试验无法完全显示。
4、相关考察指标:主要药效学指标(抑瘤率,半数有效量等),次要药效学指标;提示作用机制的指标(药物靶分子表达水平等)等的考察。
体内药效动物模型选择
动物模型选择是体内药效研究的关键。一般选择动物模型进行体内药效需要注意两点:一是动物模型跟人体的相似性,即动物可以有效模拟人体疾病;二是药物作用机制在动物中的有效性,药物在动物模型中的可以有成功发挥药效的机制。
正如ICH指导原则中提到:“许多生物技术药物的生物学活性具有种属特异性,选择相关动物种属进行试验非常重要。相关动物种属是指受试物在此类动物上受体或抗原表位有表达,能够产生药理活性,其对生物制品的生物学反应能模拟人体反应。”[4-5]
近年来,与人类疾病相似的动物模型开发取得很大的发展,包括诱发的和自发的疾病模型、基因改造动物。这些模型可对药物做出药效评估和剂量选择,也有助于确定药物安全性。

Preclinical in vivo efficacy models for oncology drug discovery[6]
对于肿瘤免疫领域,新型抗体肿瘤免疫药物的出现,对动物模型提出了更高的要求,而基因编辑人源化小鼠将小鼠的免疫检查点等靶点基因进行人源化改造,也可将接种改造的肿瘤细胞系进行个别基因的人源化改造,可以更加贴近真实的人类肿瘤治疗作用机制,有效地筛选和评价人源肿瘤免疫抗体药物,由于其独有的优势也越来越获得大范围的使用和认可。基于重度免疫缺陷小鼠(比如 JAX NSG小鼠,百奥赛图B-NDG小鼠)的免疫重建系统模型、PDX模型可以接种人源的肿瘤,保留了肿瘤的细胞和遗传特征,也是很好的评价药物的动物模型,但其批间差异比较大,获得药物评价所需的大批量稳定可重复的模型还需要更多的探索和开发。
参考资料:
[1]http://blogs.nature.com/news/2012/09/pharma-comes-together-over-clinical-trials.html
[2]Haughey D.B., Jardieu P.M. (2004) The Pharmacokinetics and Pharmacodynamics of Monoclonal Antibodies. In: Subramanian G. (eds) Antibodies.
[3] Lobo, E. D., Hansen, R. J., & Balthasar, J. P. (2004). Antibody Pharmacokinetics and Pharmacodynamics. Journal of Pharmaceutical Sciences, 93(11), 2645–2668.
[4] 治疗用生物制品非临床安全性技术审评一般原则(2010)药品审评中心
[5] ICH指导原则:生物技术药物临床前安全性评价(S6 R1)
[6] Gould, S. E., Junttila, M. R., & de Sauvage, F. J. (2015). Translational value of mouse models in oncology drug development. Nature Medicine, 21(5), 431–439.
