免疫疗法已被证明是一种很有前途的治疗方法,但由于免疫相关的潜在严重不良反应,使许多研究人员依赖小鼠模型来获得对于研究的治疗产品或疗法进行更深入的了解。从早期研发到临床的整个过程中,IsoPlexis的单细胞解决方案一直在这方面帮助研究人员,通过体外实验获得与体内活性相关的指标。
通过检测每个细胞同时分泌多个细胞因子的能力,即细胞的多功能性,检测最有效的细胞亚群进而建立这种联系。对于单细胞多功能检测,允许研究人员发现临床前发展的新机制,并加速他们的研究。相比于传统的动物模型实验有着很大的优势。
IsoPlexis单细胞蛋白组技术使用了一种综合的评价标尺——细胞多功能指数(PSI),对细胞的功能进行表征。PSI作为单细胞功能生物标志物的新标准,可以帮助研究人员加速他们的免疫治疗项目。
这个新解决方案运行在IsoLight、IsoSpark和IsoSpark Duo系统上,与之配套的是通用的IsoCode芯片。一张芯片可分离500-1500个单细胞,进行单细胞培养,检测细胞的分泌蛋白。独特的条形码技术可同时检测一个细胞分泌的多达32种细胞因子。这使得研究人员能够深入研究细胞的功能。
”
IsoPlexis新的解决方案,加快体内实验及研发进程
使用小鼠模型进行体内研究可能需要几周的时间,而使用IsoPlexis平台的研究人员可以更快地得到结果。我们来看一下两个相关的应用案例。
多功能性GPC3 CAR-T
治疗小鼠原位肝癌
Glypican3(GPC3) 是Wnt依赖性细胞增殖的抗原,在肝癌 (HCC)中高表达。2020年在Gastroenterology(IF = 22.682)文章中报道,研究者利用基于人源化YP7(hYP7)和HN3抗体制备CAR-T细胞,靶向GPC3,并评价其功能。
多功能T细胞是T细胞的一个亚群,能够在单细胞水平上共同产生两个或多个细胞因子/趋化因子,最近有报道称它们在临床环境中与持久免疫反应相关。研究者使用IsoPlexis的单细胞蛋白组技术对制备的CAR-T进行了功能评价。使用能够同时检测32种关键的T细胞免疫因子的芯片对CAR-T细胞分泌的细胞因子进行检测,比较了CAR(HN3)T细胞或CAR(hYP7)T细胞的多功能性,与Mock对照组相比,CAR(hYP7)T细胞能够分泌多种因子的细胞比例更高,表现出更强的多功能性,提示可能有着更强的功能、更好的治疗效果(图1)。
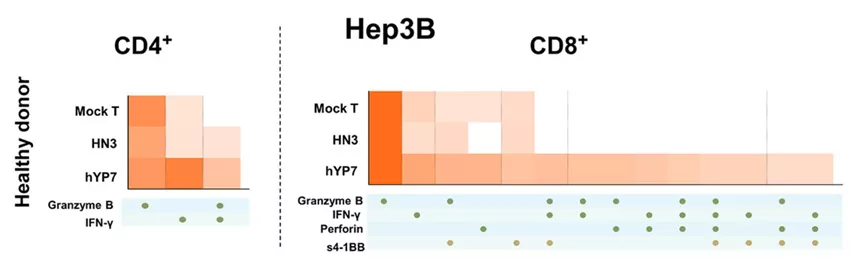
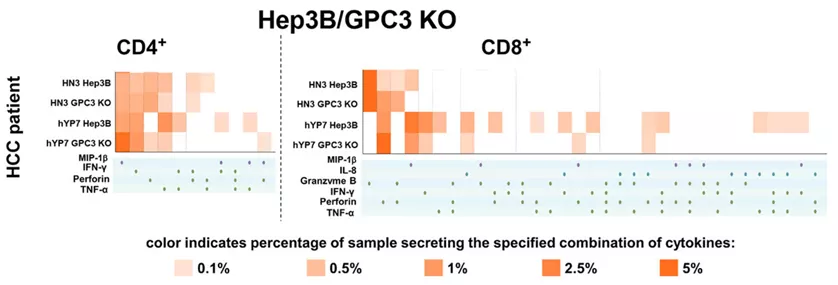
图1:Heatmap图显示hYP7 CAR-T细胞中表现出更强的多功能性。
在之后的小鼠模型实验中,研究者在NOD/SCID/IL-2Rgcnull(NSG)小鼠腹腔注射表达荧光素酶的Hep3B或HepG2细胞。在肿瘤形成后,小鼠注射生理盐水或未转导的T细胞(Mock),或不同剂量的CAR(HN3)T细胞或CAR(HYP7)T细胞。结果显示,在CAR(HN3)T细胞处理的小鼠中没有发现明显的肿瘤生长抑制。接受20 M CAR (hYP7) T细胞治疗的小鼠在第70天均存活,没有复发。接受hYP7 CAR-T细胞注射的小鼠的治疗效果是更好的(图2)。
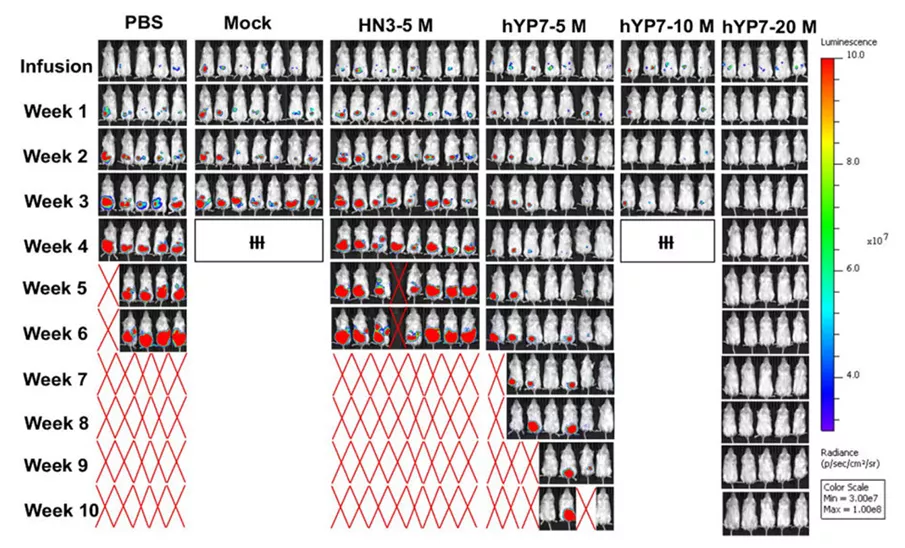
图2:对照与多种剂量不同CAR-T组效果对比
Li D, Li N, Zhang YF, Fu H, etc. Persistent Polyfunctional Chimeric Antigen Receptor T Cells That Target Glypican 3 Eliminate Orthotopic Hepatocellular Carcinomas in Mice. Gastroenterology. 2020 Jun;158(8):2250-2265.e20.
基于APRIL三聚体(TriPRIL)设计的CAR-T细胞靶向治疗多发性骨髓瘤
![]()
2019年Blood Advances杂志上题为《Rational Design of a Trimeric APRIL-Based CAR Binding Domain Enables Efficient Targeting of Multiple Myeloma》的文章中,研究者发表了基于APRIL三聚体的CAR结合域的合理设计靶向多发性骨髓瘤的研究进展。
在多发性骨髓瘤的治疗和研究中,CAR-T细胞治疗提供了新的治疗路径,其中靶向B细胞成熟抗原(BCMA)的CAR-T细胞治疗是迄今为止最有希望的治疗方式,但其疗效仍然存在挑战,因为在单特异性抗BCMA CAR-T细胞治疗的选择压力下,会出现BCMA抗原逃逸变异,从而导致疾病复发,因此仍需要不断改进CAR-T细胞以改善多发性骨髓瘤的疗效。
在这里研究者证实了基于APRIL三聚体的新型CAR(图3)能有效地靶向BCMA阳性和BCMA阴性的多发性骨髓瘤。双特异性、基于三聚体APRIL的CAR是一种很有前途的治疗多发性骨髓瘤的方法,有可能预防和治疗BCMA抗原逃逸。
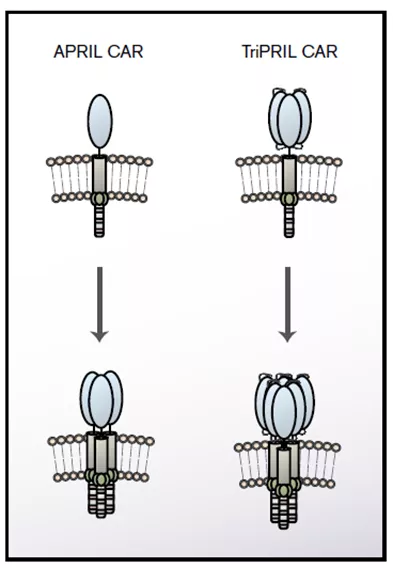
图3:APRIL和TriPRIL CARs设计
研究者将对照T细胞(UTD)、BCMA、APRIL和TriPRIL CAR-T同表达BCMA和TACI的靶细胞一起培养,靶细胞会刺激T细胞分泌细胞因子,使用IsoPlexis检测32种细胞分泌蛋白的条形码芯片捕获T细胞表达细胞因子。相对于其它实验组,TriPRIL CAR-T组细胞中的多功能细胞的比例显著提高(图4),单细胞分析表明,CD4+和CD8+T细胞主要分泌效应型细胞因子,在不同的CAR-T中细胞因子分泌谱相似,但分泌频率有显著差异(图5)。
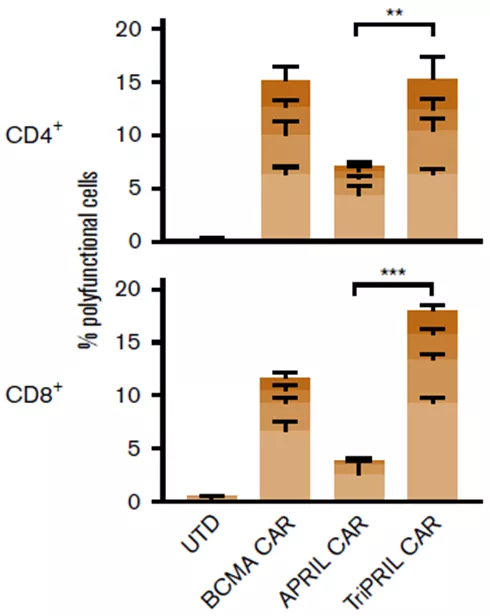
图4:单细胞蛋白质组学检测不同CAR-T的多功能细胞的比例
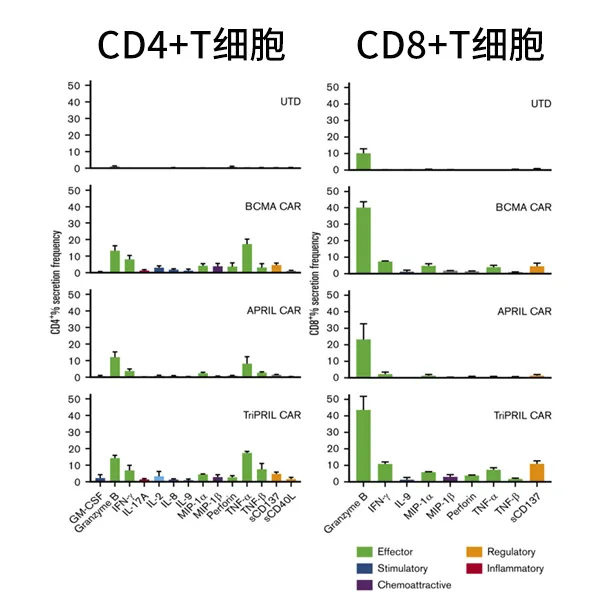
图5:单细胞水平表征分泌因子图谱
动物实验方面,在BCMA阳性小鼠肿瘤模型中,BCAM和TriPRIL CAR-T的治疗效果都是很好的;在BCMA阴性小鼠肿瘤模型中,因为肿瘤抗原逃逸,只有TriPRIL CAR-T取得了很好的治疗效果(图6)。
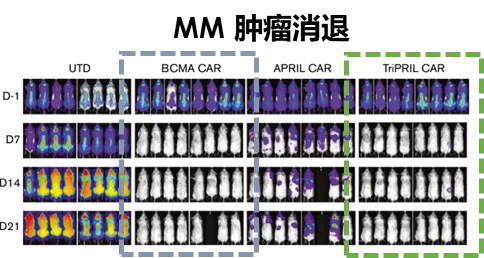

图6:小鼠实验结果,TriPRIL CAR-T有效靶向BAMA阳性和阴性的多发性骨髓瘤。
Schmidts A , Ormhj M , Choi B D , et al. Rational design of a trimeric APRIL-based CAR-binding domain enables efficient targeting of multiple myeloma - ScienceDirect[J]. Blood Advances, 2019.
总结
动物实验动辄需要数个星期,甚至如第一个实验,需要持续70天;单细胞蛋白组技术在一周内即可完成细胞功能的表征。应用于体内疗效相关性分析时,单细胞蛋白组技术体现了以下特点:
其结果与动物实验是可比的;
可以很好的优化研究和药物研发流程;
够加快体内实验的进程,节省宝贵的时间;
找到关键分泌蛋白,指导后续研究。

