单克隆抗体杂交瘤细胞筛选技术-ClonePix 2
1986年,美国FDA批准了第一个单克隆抗体药物上市,距今已快30年。目前,全世界共有超过40个治疗用抗体药物被批准上市,每年实现超过600亿美元的销售额。在国际及国内形成了抗体药物开发热潮。巨大的市场前景和现存的技术问题及壁垒并存的现实不可避免地引发抗体药物新一轮技术革命。而其结果又将毫无疑问地改变抗体药物的市场格局。
但是,抗体不管是作为检测试剂,还是作为具有巨大市场前景的治疗药物。首先,我们都需要通过筛选找到单克隆抗体。传统的单克隆抗体制备方法主要是杂交瘤技术。这是目前比较成熟,技术难度比较低,大多数实验室仍然在使用的方法。
在单克隆抗体制备过程中,有两次筛选过程,第一次是使用选择性培养基选出杂交瘤细胞;第二次就是进一步选出能产生我们需要的抗原特异性抗体的杂交瘤细胞。
利用杂交瘤技术制备单克隆抗体的基本原理是根据以下三个原则:
1、一种淋巴细胞克隆只产生一种抗体;
2、细胞融合技术产生的杂交瘤细胞可以保持双方亲代细胞的特性;
3、利用代谢缺陷补救机理筛选出杂交瘤细胞,并进行克隆化,然后大量培养增殖, 制备所需的单克隆抗体。
第一次筛选的原理和方法:
细胞融合后,杂交瘤细胞的选择性培养是第一次筛选的关键。普遍采用的HAT选择性培养液是在普通的动物细胞培养液中加入次黄嘌呤、氨基蝶呤和胸腺嘧啶核苷酸。其依据是细胞中DNA的合成有两条途径:
一条途径是生物合成途径(D途径),即由氨基酸及其他小分子化合物合成核苷酸,为DNA分子的合成提供原料。在此合成过程中,叶酸作为重要的辅酶参与这一过程,而HAT培养液中氨基蝶呤是一种叶酸的拮抗剂,可以阻断DNA合成的“D途径”。
另一条途径是应急途径或补救途径(S途径),它是利用次黄嘌呤-鸟嘌呤磷酸核苷转移酶(HGPRT)和胸腺嘧啶核苷激酶(TK)催化次黄嘌呤和胸腺嘧啶核苷生成相应的核苷酸,两种酶缺一不可。
因此,在HAT培养液中,未融合的B细胞及两个B细胞的融合产物的D途径被氨基蝶呤阻断,虽S途径正常,但因缺乏在体外培养液中的增殖能力,一般在10天左右会死亡。对于骨髓瘤细胞以及自身融合细胞而言,由于通常采用的骨髓瘤细胞是次黄嘌呤-鸟嘌呤磷酸核苷转移酶(HGPRT)缺陷细胞,因此自身没有S途径,且D途径又被氨基蝶呤阻断,所以在HAT培养液中也不能增殖而很快死亡。只有骨髓瘤细胞与B细胞相互融合的杂交瘤细胞,既具有B细胞的S途径,又具有骨髓瘤细胞在体外培养液中长期增殖的特性,因此能在HAT培养液中选择性存活下来,并不断增殖。
第二次筛选的原理和方法:
在单克隆抗体的生产过程中,由于B淋巴细胞的特异性是不同的,经HAT培养液第一次筛选出的杂交瘤细胞产生的抗体存在多样性,必须对杂交瘤细胞群进行第二次筛选,才能选出针对目标抗原具有特异性的杂交瘤细胞。二次筛选通常采用有限稀释法,将杂交瘤细胞多陪稀释,接种在多孔细胞培养板上,使每孔不超过一个细胞,通过培养让其增值。然后检测各孔上清液中细胞分泌的抗体的特异性(常用ELISA方法),上清液可与特定抗原结合的培养孔为阳性孔。阳性孔中细胞还不能保证是来自单个细胞,需要继续进行有限稀释,一般重复3-4次,直至确信每个孔中增值的细胞为单克隆细胞。第二次筛选也是鉴定特异性亲和力的过程。
有限稀释法对于筛选杂交瘤来说,是最普通的方法,在许多实验室中都在使用。但是,作为相对旧的技术,已经不能满足当今的需求。方法自身具有许多缺点:
1、人工操作,操作及重复的步骤太多,不可避免容易出错。
2、速度慢,效率低。只能保证30-40%的孔有细胞生长。对于高通量筛选来说,不能满足要求。
3、不能保证单克隆,需要亚克隆3-4次,所以,人工和耗时都较多。
4、有限稀释在ELISA检测前,并不知道哪一个克隆满足抗原特异性的要求。所以,需要对所有克隆,都要最少做一次ELISA鉴定。
除了有限稀释方法,现在相对先进的细胞分选技术也得到普遍应用。一般就是细胞分选仪或者流失细胞技术对杂交瘤细胞进行筛选。其原理是先将细胞分散开,没有细胞结团。通过在细胞表面或细胞内标记荧光信号。当单个细胞在压力作用下单个通过玻璃毛细管的时候,仪器可以自动检测单个细胞的荧光信号强度。荧光信号强度反应这个细胞的相应抗体表达水平。最后,将高荧光信号强度的细胞收集,再通过有限稀释得到高水平表达的单克隆;或者也可以使用单细胞收集器收集高水平表达的单个杂交瘤细胞。
细胞分选或者流失细胞技术的筛选原理如下图所示:
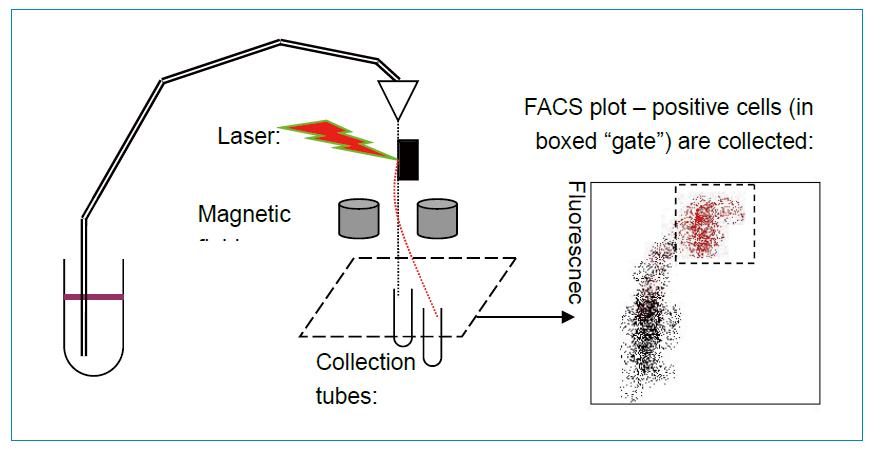
这种技术也在很多实验室中使用,但是根据其筛选原理,有一些不可避免的缺陷。
1、由于必须要对细胞表面或内部使用荧光标记,所以,一般主要使用于胞内表达的蛋白或者膜表达蛋白。对于分泌表达的杂交瘤细胞来说,使用具有局限性。
2、具体检测的是单个细胞在某个时间点的荧光强度。所以,检测结果容易受细胞周期的影响。而且,单个细胞的表达水平也不能很好反应后期生产阶段细胞群体的表达水平。
3、流失筛选技术只是对荧光信号强的所有细胞作出划分,后期需要复筛的细胞数目仍然很多,下游工作量仍然比较大。
4、由于对单个细胞使用压力操作,剪切力会降低细胞存活率。所以,低成活率也成为这个技术的一个主要缺陷。
5、流失筛选需要对管路系统充分清洗消毒才能确保细胞不会污染,污染的风险较高。
随着技术进步,我们也迫切需要一种更先进的筛选技术。能够满足高通量,自动化,高效率的要求。现在,一种新的杂交瘤筛选技术平台Clonepix2技术已经出现,并且在世界范围内得到广泛使用,实践证明其能够大大加快杂交瘤筛选速度,并且提高效价,降低成本。其筛选原理如下:
1、 使用半固体培养的方法,使细胞在培养基上生长成单个独立分散的单克隆;半固体培养基可以阻止克隆移动,保证筛选到的克隆是单克隆。
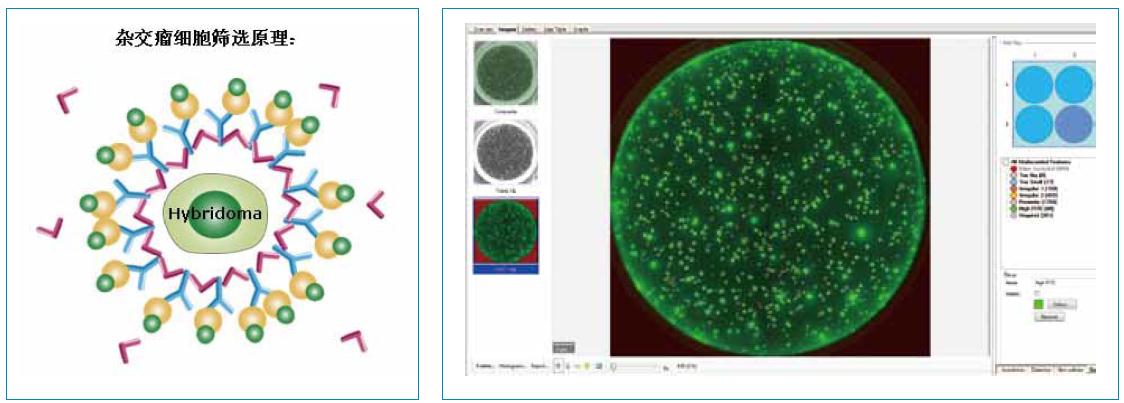
2、 在半固体培养基中加入荧光标记克隆检测试剂。克隆检测试剂、营养因子以及克隆表达的蛋白分子都可以自由在半固体培养基中扩散。当荧光标记检测试剂捕获目标蛋白分子后,形成分子复合体。复合体大分子聚集在克隆的周围。而且,随着克隆生长时间延长,聚集更多荧光蛋白复合体。
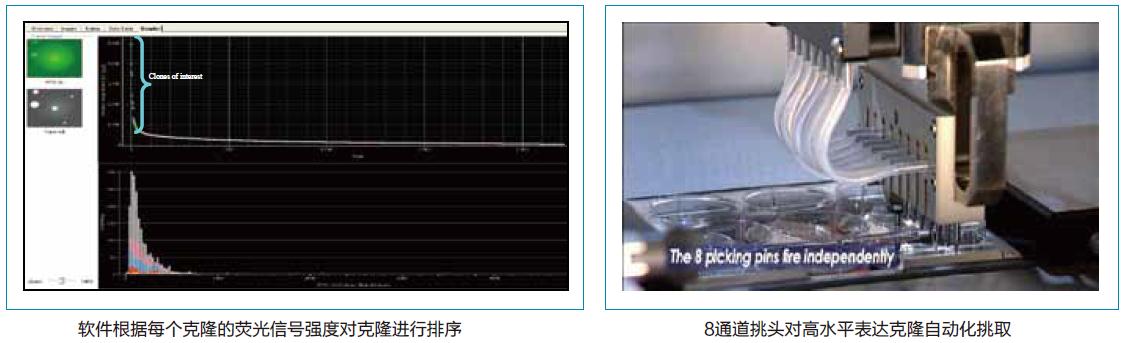
3、 软件在白光下识别细胞克隆,在荧光下对克隆的荧光水平进行定量。并且,机械臂及挑头可以自动化挑取荧光水平高的细胞克隆到96孔微孔板。
最为最新一代技术,Clonepix2技术在筛选杂交瘤方面具有许多优点:
1、第一次将克隆的筛选自动化,可以更少时间,筛选更多克隆。
2、筛选杂交瘤效率高。由于筛选过程以及挑克隆的自动化,可以在短时间内筛选大量克隆,所以大大提高找到稀少的高产克隆的概率。
3、高效率也大大减少人力,增加杂交瘤筛选的通量,同一时间可以运作更多项目。
4、由于快速筛选更高水平克隆用于下游生产,同时尽可能早的丢弃掉低产的克隆,将目标专注于稀少的高产克隆,也避免了有限稀释,大大减少下游生产成本;同时节省耗材。
作为杂交瘤筛选的最新技术,也存在一些缺点。比如,首先杂交瘤要能在半固体培养基上生长良好,所以,合适的培养基就尤为重要。其次,克隆的大小和密度对于自动化挑取克隆的精确性有很大影响。克隆太小,会影响识别和挑取。克隆太密,容易影响挑到克隆的单克隆性。最后,机械臂对于挑选精度要求比较高,所以,设备的日常维护就非常重要。
在抗体药物快速发展的今天,技术进步对于快速筛选到特异性的杂交瘤就显得非常重要,可以大大加快筛选进程,缩短抗体药物从研发到临床及生产上市的周期。对于抗体行业的快速发展将起到不和缺少的推动作用。
