
期刊:Frontiers in Molecular Neuroscience
影响因子:6.2610
导读
在2.46亿糖尿病患者中,大约三分之一有糖尿病视网膜病变(diabetic retinopathy, DR)的迹象。DR的发病机制非常复杂,尚未完全阐明,其基本病理变化是血视网膜屏障(blood retina barrier, BRB)的破坏和视网膜新生血管的形成。
科学问题
由于参与视网膜炎症反应的细胞数量众多,细胞之间的调节机制复杂,血视网膜内屏障(inner BRB, iBRB)在DR早期损伤的机制尚不完全清楚,其探索仍然是一个重大挑战。
研究技术
scRNA-seq,免疫荧光
(部分技术服务由伯豪生物提供)
方法
本研究主要使用了单细胞转录组测序技术(scRNA-seq),使用了5个大鼠视网膜样本(2只正常SD大鼠;3只DR大鼠,在造模2周、4周和8周各1只),总共检测35,910个转录本,探讨了DR早期iBRB损伤的细胞机制。
结论
本文探索了周细胞、内皮细胞和两种缪勒氏细胞亚型的特征,并在DR早期构建了它们之间的调控网络。研究结果再次强调了iBRB的重要作用,为保护iBRB和抑制DR的进一步发展提供了有潜力新的靶点,具有深远的临床意义和社会价值。
研究路线图
研究结果
1. 血液-视网膜内屏障(iBRB)中细胞类型图谱
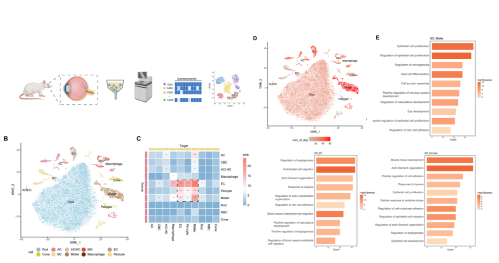
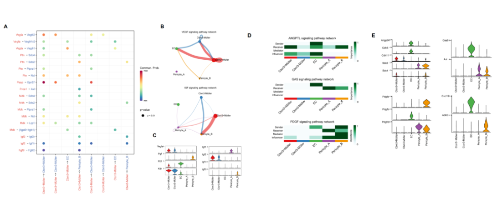
为了模拟早期DR,实验使用链脲佐菌素(streptozotocin, STZ)在大鼠中构建2型糖尿病模型。实验剥离了5只大鼠的视网膜(2只正常大鼠;3只用STZ处理大鼠,每只分别处理2周、4周和8周),对组织进行解离稀释并进行单细胞转录组测序。质控过滤后,保留了35,910个高质量细胞:11,073个来自正常样本;24,837个来自糖尿病大鼠样本。将聚类分群的33个cluster分为10种细胞类型,可概括为两大类别包括:血液来源的巨噬细胞类群和视网膜驻留细胞类群。其中视网膜驻留细胞包括神经元细胞(棒细胞、锥细胞、视网膜水平细胞、无长突细胞和双极细胞)、胶质细胞(缪勒氏细胞和小胶质细胞)、内皮细胞和周细胞。基于CellChat分析,发现内皮细胞、周细胞和缪勒氏细胞比其他细胞具有更复杂的通信模式。此外,本文计数了正常大鼠和糖尿病大鼠中不同细胞群差异表达基因数量(differentially expressed genes, DEGs),结果显示构成iBRB的细胞:缪勒氏细胞、内皮细胞和周细胞在DR早期发生显著改变。GO富集分析显示,这三种细胞类型都与血管的形成和增殖、缺氧和细胞粘附有关。周细胞显示与血管收缩相关,而缪勒氏细胞与神经元的形成和发育有关。
2. 缪勒氏细胞两种亚型的特征
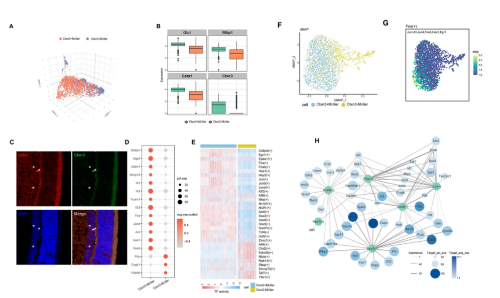
在DR的早期,缪勒氏细胞损伤可导致视网膜稳态的破坏。根据前面的标志物(Apoe, Glul, Clu),进一步细分两组缪勒氏细胞亚群,并命名为Ctxn3+缪勒氏细胞和Ctxn3-缪勒氏细胞。利用免疫荧光验证两个亚群在组织的存在,但由于结果的模糊性,后续还需要进一步进行更多的实验。通过前期的文献调研发现,γ-氨基丁酸(GABA)转运蛋白,细胞膜上的谷氨酸转运蛋白,胞内谷氨酰胺合成酶,这些均消除谷氨酸积累,减少其引起的细胞毒性。而这两组亚群中Ctxn3+缪勒氏细胞呈现比较强的GABA转运代谢的功能。Ctxn3+缪勒氏细胞同时还特异性高表达血管粘附因子(vascular adhesion molecule, VCAM1),还能释放炎症因子如:IL33。这些都表明Ctxn3+缪勒氏细胞和视网膜的炎症反应相关性更强。通过SCENIC分析,结合转录因子进一步分析Ctxn3+缪勒氏细胞在疾病中的作用。结果显示两类转录因子在Ctxn3+缪勒氏细胞中主要上调;(1) AP-1家族成员,如:Jun、Fos和Jund;(2) SOX家族成员,如:Sox2和Sox9。UMAP图显示了重要转录因子下游靶基因的表达情况。通过网络图,我们发现AP-1家族可以调节Id蛋白(DNA结合/分化抑制蛋白)的变化。
3. 内皮细胞和周细胞的特性及其相互关系
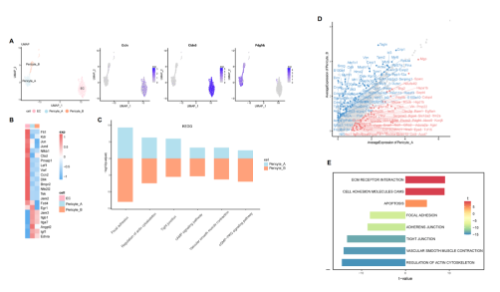
血小板衍生生长因子受体β(Platelet-derived growth factor receptor beta, pdgfrβ)在血管壁细胞的发育中发挥重要作用(包括周细胞和血管平滑肌细胞)。结果显示pdgfrβ在cluster 20和cluster 27中高表达。因此,将这两个细胞群进一步定义为周细胞的亚群,分别命名为周细胞A亚群和周细胞B亚群。通过分析血管内皮细胞的特征,发现了一系列有潜力的新靶点。KEGG分析显示,周细胞A亚群和周细胞B亚群均表现血管平滑肌收缩功能增强,该功能与周细胞局部调节微血管血流的特征相关。随后分析比较了两组周细胞基因集变异分析(GSVA),结果显示周细胞A亚群具有增加的ECM受体相互作用和其他途径,而周细胞B亚群富集血管平滑肌收缩和肌动蛋白细胞骨架调节等途径。
4. 缪勒氏细胞和iBRB的通讯网络
为了揭示早期DR中iBRB损伤的潜在机制,本文深入研究了缪勒氏细胞、内皮细胞和周细胞之间的复杂通讯。使用CellChat分析,我们发现缪勒氏细胞通过分泌因子在iBRB的调节中发挥着潜在作用。研究表明,Vegf/Vegfr2信号通路最有可能影响生物合成、分泌,也参与到缪勒氏细胞脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)和胶质细胞源性神经生长因子(glial cell-derived neurotrophic factor, GDNF)降解过程,从而促进缪勒氏细胞的存活并具有神经保护作用。此外,两组缪勒氏细胞均分泌胰岛素样生长因子2 (Igf2),该因子作用于周细胞B亚群上的受体Igf2r,调节其增殖分化和存活。血管生成素样蛋白4(Angiopoietin-like protein 4, Angptl4)由内皮细胞分泌,不仅作用于缪勒氏细胞和周细胞,还影响自身。内皮细胞通过Angptl4-Cdh11/Sdc4/Sdc2对缪勒氏细胞和周细胞具有一定的调节作用,但其具体功能值得进一步研究。
参考文献:
Wang Y, Yang X, Li Q, et al. Single-cell RNA sequencing reveals the Müller subtypes and inner blood-retinal barrier regulatory network in early diabetic retinopathy. Front Mol Neurosci. 2022;15:1048634. Published 2022 Dec 1. doi:10.3389/fnmol.2022.1048634
