随着越来越多的生物制品(重组蛋白疫苗、Vero细胞疫苗、细胞治疗/基因治疗药物等)进入治疗领域,生物制品的质量控制也日趋严格,其中核酸残留因其潜在的危害性,是各类质控标准的重中之重。我国参照WHO、FDA和欧盟标准,在药典中明确规定酵母、大肠杆菌表达的生物制品中DNA残留量不超过10ng/剂量。我国2020年药典将人用狂犬病疫苗(Vero细胞)DNA残留标准更新为≤3ng/剂量。除了残留量的规定,FDA、CDE发布的相关指导文件中建议,残留的细胞宿主DN**段不能超过一个功能基因的长度(约200bp)1,2。因此,在生物制品的生产工艺中必须有去除核酸残留的步骤,确保生物制品的中的核酸残留满足相应法规的要求。
| 近岸蛋白提供高品质GMP级全能核酸酶(BenzoNuclease®)及高性能配套全能核酸酶残留检测试剂盒(检测范围0.014-10ng/ml),灵敏度高,为生物制品解决核酸残留困扰。 |
在核酸残留去除工作中,难点是由于DNA带有大量的电荷易与其他生物大分子结合从而产生聚集(吸附)、包裹作用而难以完全除去。传统的方法均存在低含量核酸残留去除不净、工作量大耗时长的缺陷。全能核酸酶是一种来自于erratia marcescens,经基因工程改造的核酸内切酶,可降解双链、单链、线状、环状的DNA和RNA,完全将核酸降解成3~5个碱基长度的5'-单磷酸寡核苷酸。目前已广泛应用于病毒载体疫苗、基因与细胞治疗等企业的病毒纯化工艺中。
生物制品领域迎空前发展机遇,供应链协同需加强
2021年12月30日,国家药监局等8部门联合印发《“十四五”国家药品安全及促进高质量发展规划》,提出支持药品、医疗器械、疫苗等领域的创新发展,推动关键核心技术攻关,促推解决产业创新发展的“卡脖子”问题,提升产业整体水平。
同日,工信部等9部门联合印发《“十四五”医药工业发展规划》,提出在疫苗领域,重点发展新型新冠病毒疫苗、疱疹疫苗、多价人乳头瘤病毒(HPV)疫苗、多联多价疫苗等产品。在其它领域,重点发展针对新靶点、新适应症的嵌合抗原受体 T 细胞(CAR-T)、嵌合抗原受体 NK 细胞(CAR-NK)等免疫细胞治疗、干细胞治疗、基因治疗产品和特异性免疫球蛋白等。重点开发超大规模(≥1 万升/罐)细胞培养技术,双功能抗体、抗体偶联药物、多肽偶联药物、新型重组蛋白疫苗、核酸疫苗、细胞治疗和基因治疗药物等新型生物药的产业化制备技术,生物药新给药方式和新型递送技术,疫苗新佐剂。强调新型疫苗研发和产业化能力建设。紧跟疫苗技术发展趋势,基于应对新发、突发传染病需求,支持建设新型病毒载体疫苗、脱氧核糖核酸(DNA)疫苗、信使核糖核酸(mRNA)疫苗、疫苗新佐剂和新型递送系统等技术平台,推动相关产品的开发和产业化。鼓励疫苗生产企业开展国际认证,按照国际疫苗采购要求生产、出口疫苗。
《“十四五”医药工业发展规划》鼓励疫苗生产企业和关键原辅料、耗材、设备企业加强协作,针对应急状态下可能出现的峰值需求,提高供应链应急适配能力。提高疫苗供应链保障水平。支持疫苗企业和重要原辅料、耗材、生产设备、包装材料企业协作,提高各类产品质量技术水平。
目前全能核酸酶的应用市场主要还是被国外企业占据,其价格高、供货周期长,且受疫情和国际贸易政策影响,存在供应中断风险。因此,生物制品生产企业需要将视线转向国内同类产品,这也符合目前国产供应链建设的大趋势。
近岸蛋白全能核酸酶质优价廉
近岸蛋白提供GMP级条件下生产的BenzoNuclease®,无动物源性,无氨苄青霉素,可高效降解单链、双链、线性、环状、超螺旋等任何形式的DNA及RNA。质量、性能、供货能力可靠,并已完成在FDA的药物主文件(Drug Master File, DMF)申报备案,满足药物申报的规范。

什么是全能核酸酶?
BenzoNuclease®是一种来自于Serratia marcescens,经基因工程改造的核酸内切酶。BenzoNuclease®可降解单链、双链、线性、环状、超螺旋等任何形式的DNA及RNA,将核酸完全降解成3~5个碱基长度的5'-单磷酸寡核苷酸。因其能高效降解任何形式的 DNA 和 RNA,又被称为“全能核酸酶”。
无论在实验室研究还是在工业级生产的过程中,BenzoNuclease®是去除生物制品中所有形式DNA和RNA的一种有效工具酶。通过高效的核酸去除,可显著提升后续实验、生产的效果及产量,性能优于其他核酸去除方法。
近岸蛋白全能核酸酶的应用
● 去除疫苗类产品外源性核酸,降低核酸残留毒性风险,提高产品安全性,如病毒疫苗、溶瘤病毒、细胞和基因治疗病毒载体的纯化
● 降低细胞/细菌裂解时核酸释放产生的黏度,缩短处理时间,提高病毒/蛋白产量
● 去除缠绕在颗粒(病毒、包涵体等)表面的核酸,利于颗粒的释放和纯化
● ELISA、柱层析、二维电泳和印迹分析的样品制备,经核酸酶处理后可提高分辨率和回收率
● 用于预防细胞的结团
● ……
近岸蛋白全能核酸酶严格的质量控制及生产标准
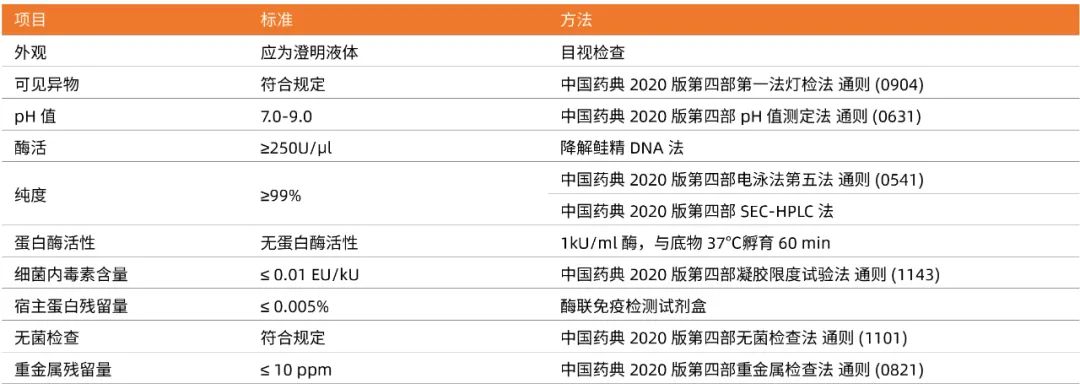
近岸蛋白全能核酸酶宽泛的反应条件
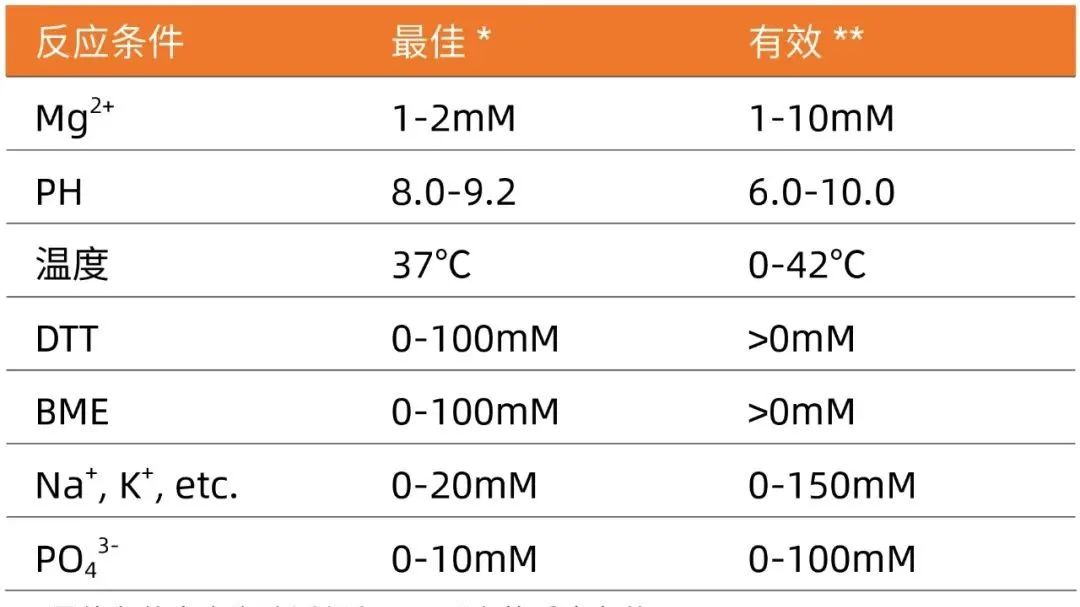
近岸蛋白全能核酸酶优异的性能
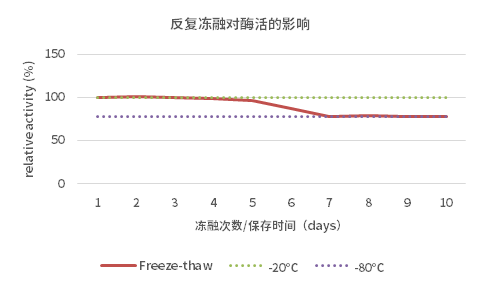
1、保存稳定性以及冻融稳定性
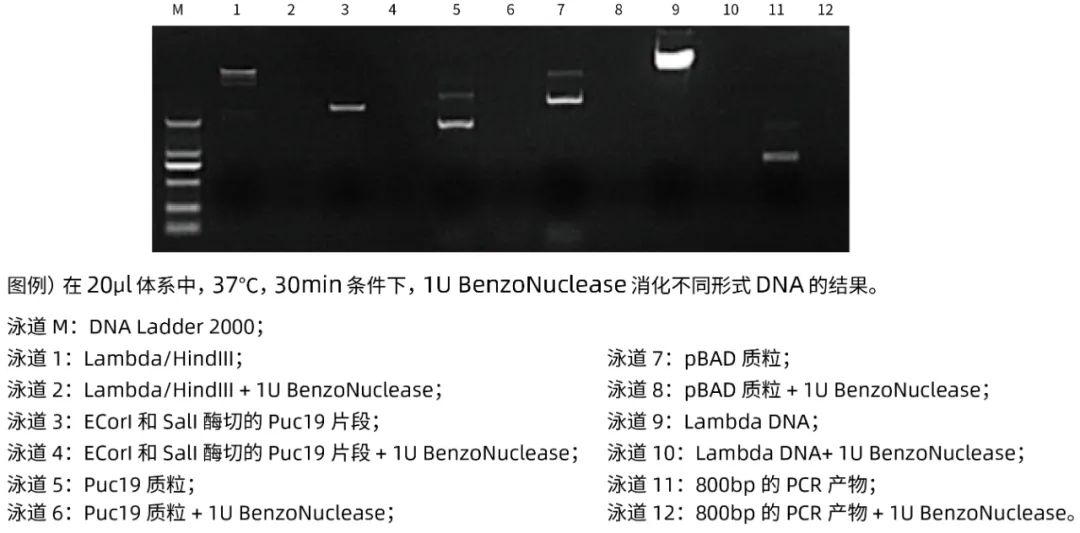
2、消化不同类型核酸
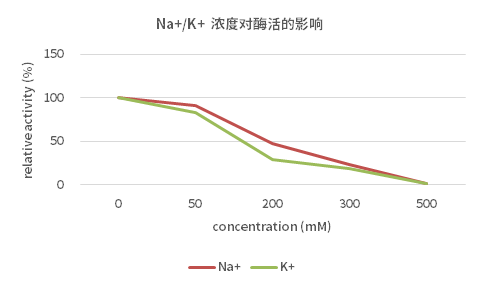
3、钠离子、钾离子的影响
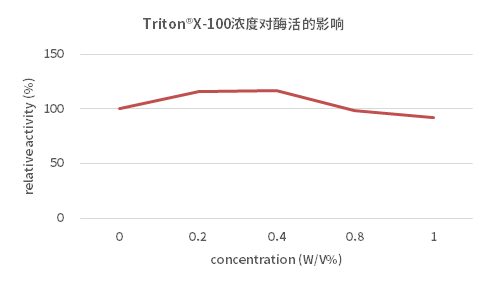
4、Triton® X-100的影响
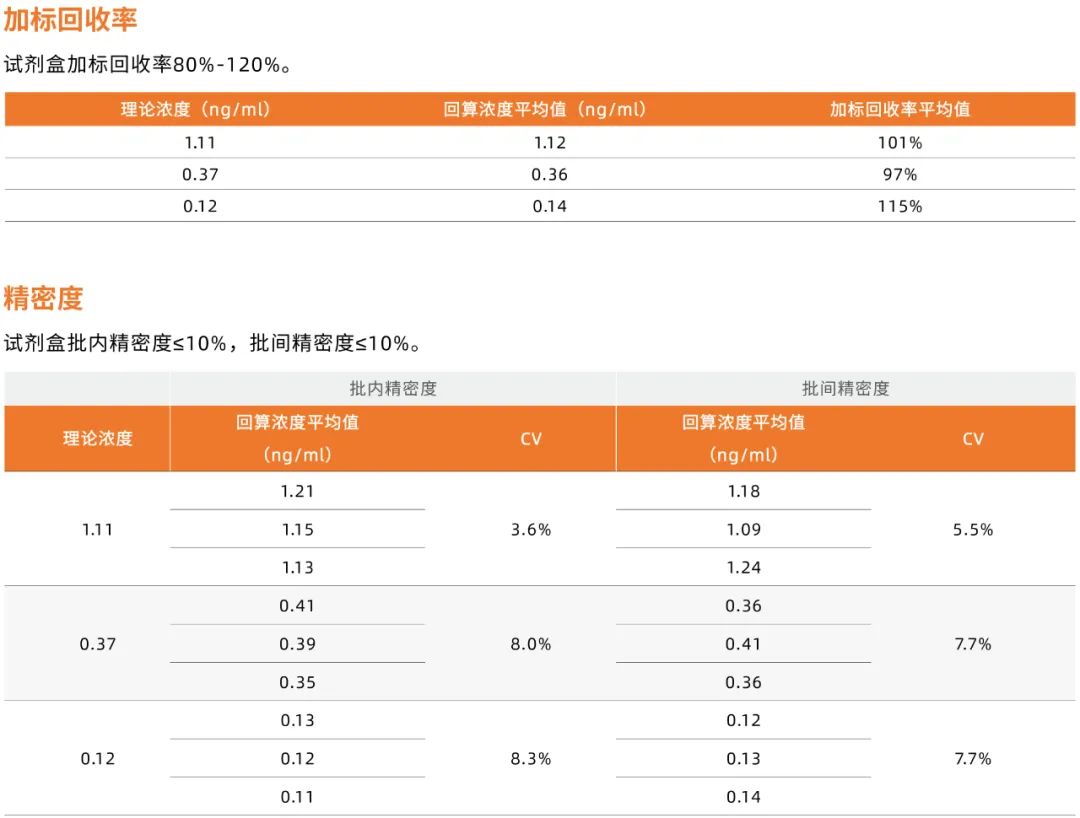
近岸蛋白全能核酸酶残留检测试剂盒性能脱颖而出
在使用核酸酶处理过的生物制品中,可能存在微量的核酸酶残留,这些微量残留会对后续生物制品的应用造成一定的影响。生物制品中核酸酶的残留量也是衡量生物制品质量的重要指标之一。
近岸蛋白开发的核酸酶残留检测试剂盒可以高灵敏度(0.014ng/ml)、检测范围0.014-10.00ng/ml, 特异性地检测和定量分析样品中的全能核酸酶残留。
近岸蛋白产品信息:
|
货号 |
产品名称 |
规格 |
|
BenzoNuclease, GMP Grade |
100KU/200KU/5000KU |
|
|
BenzoNuclease ELISA Kit |
96T |
扫码申请近岸蛋白全能核酸酶及残留检测试剂盒试用装

更多产品性能数据请联系近岸蛋白小伙伴或拨打联系电话021 5079 8060获取!
Q&A
1. 在哪一步中加入 BenzoNuclease®?
BenzoNuclease®可直接加入至细胞/细菌裂解液中进行作用。注意,若裂解液中不含Mg2+,需补加Mg2+至1-2mM。
2. 当反应温度低于 37℃时,如何保证 BenzoNuclease®的消化效果?
在体系固定的情况下,BenzoNuclease®的消化效果主要取决于酶用量、反应温度以及反应时间,当反应温度较低时,为避免过多的 BenzoNuclease®引起的残留问题,更加推荐延长反应时间来保证 BenzoNuclease®的消化效果。
3. BenzoNuclease®的抑制条件有哪些?
BenzoNuclease®可在较为宽泛的条件下保持活性,但 1-2mM Mg2+对其活性至关重要。
一般情况下,BenzoNuclease®的活性可被高盐抑制,例如:> 500 mM 的一价阳离子(如 Na+、K+等)、>100 mM 的盐酸胍(guanidine HCl)、> 100 mM 的磷酸盐(phosphate)、> 100 mM 的硫酸铵(ammonium sulfate)等。此外,螯合剂也可通过螯合体系中的 Mg2+以达到抑制酶活的作用,通过加入更多的 Mg2+可恢复 BenzoNuclease®的活性(1mM 的 EDTA 可部分抑制 BenzoNuclease®活性,5mM 的 EDTA 可使其活性丧失约 90%。
4. BenzoNuclease®与蛋白酶抑制剂可以兼容吗?
可以。但需要注意,最好选择不含 EDTA 的蛋白酶抑制剂(≥1mM 的 EDTA 可抑制 BenzoNuclease® 的活性)。
5. 如何去除 BenzoNuclease®?
BenzoNuclease®融合了 6×His 标签,可通过镍柱将其去除。此外,也可结合所生产产品本身的纯化工艺对BenzoNuclease®进行去除,如通过 TFF(tangential flow filtration)、透析及色谱(IEX, SEC, HIC)、超滤等。
6. BenzoNuclease®的应用是否有**限制?
无**限制。
7. 料液经过BenzoNuclease®处理后的核酸残留使用什么方法检测比较好?
推荐使用qPCR进行检测,qPCR方法的灵敏度和重复性较好,并且可定量,可以对核酸残留有更加准确的把握。
8. GMP-1707的储存液中含有2mM MgCl2,加到样品中之后,需要补加镁离子吗?
如果样品溶液中不含镁离子或者镁离子浓度较低,建议补加镁离子至全能核酸酶的最佳工作浓度(1-2mM)。
参考文件:
1、 FDA《用于生产和传染病适应症的病毒疫苗的细胞基质和其他生物材料的特性和鉴定》;
2、 CDE《基因治疗产品药学研究与评价技术指导原则》。
BenzoNuclease®是苏州近岸蛋白质科技股份有限公司的注册商标。其他商标归其所有者所有。
苏州近岸蛋白质科技股份有限公司,是一家专注于重组蛋白应用解决方案的高新技术企业,主营业务为靶点及细胞因子类蛋白、重组抗体、酶及试剂的研发、生产和销售,并提供相关技术服务。公司定位为医疗健康与生命科学领域原料与技术解决方案的上游供应商,致力于为下游客户提供及时、稳定、优质的产品及服务,助力全球生物医药企业和研究机构的技术与产品创新升级。
详询www.novoprotein.com.cn或致电400-600-0940。
