当裂解物样品经过 SDS-PAGE 电泳过程,准备转移到膜上以进行蛋白质印迹检测。但如果不这样做呢?
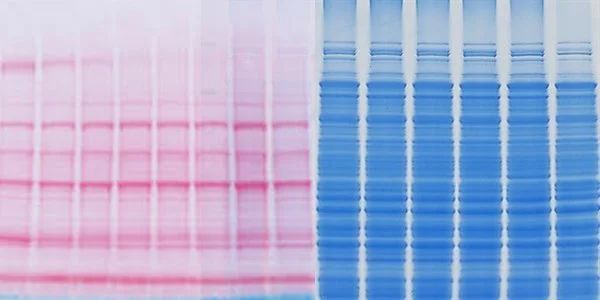
试想一下,如果经过完整的实验步骤后,您的条带不在您期望的范围内,则可能需要对抗体进行故障排除,但还应该对电泳和转移步骤进行故障排除。其实,可以在转膜或电泳后通过用 Ponceau S(丽春红) 或考马斯亮蓝染色来观察总蛋白迁移的情况。
1) Ponceau S & 考马斯亮蓝
Ponceau S 染色液和考马斯亮蓝染色可实现电泳后蛋白质转移的可视化。它们对于确认蛋白质转移、目标靶点的存在以及节省时间、实验样本非常重要。此外,它们能显示出印迹中任何瑕疵(例如气泡、转印不均匀)。
2) 选择哪一种染料?
Ponceau S 和考马斯亮蓝染色都是带负电的溶液,它们与带正电的氨基酸基团和非极性蛋白区域结合。
膜和蛋白水平
Ponceau S 检测到的蛋白质水平为 200 ng 以上,与 PVDF、硝化纤维或尼龙膜兼容。传统的考马斯亮蓝仅与 PVDF 膜兼容,但可以检测 50 ng 及以上的蛋白质。染色灵敏度高可能很重要,但也要看具体的样品类型和进行的检测。
使用考马斯亮蓝溶液就不能继续进行蛋白质印迹分析。这是因为溶液中存在的醇和酸会在使用后将蛋白质样品固定在凝胶中。Ponceau S 染色液不能固定蛋白质,因此可以在染色后进行蛋白质印迹分析。
实验时长
可用的考马斯亮蓝染色溶液有几种类型,并且实验步骤略有不同,时间上从两个小时到一整天不等。最常用的一种考马斯亮蓝 G-250 可以按以下方式使用:电转移后,用 ddH2O 洗涤聚丙.烯酰胺凝胶 3 次。在聚丙.烯酰胺凝胶上添加至少 25mL(或直到凝胶被覆盖)染色溶液。将带有染色溶液的凝胶放在摇床上,并缓慢搅拌,以防止凝胶粘附到容器上。染色时间取决于凝胶厚度和丙.烯酰胺的百分比。可能需要两个小时或更长时间才能在凝胶上看到均匀的蓝色。凝胶染色后,用 ddH2O 洗涤凝胶,并轻轻摇动一到两个小时,换几次 ddH2O 以去除多余的游离染料。
Ponceau S 染色实验步骤大约需要 20 分钟,并且无毒,并且比考马斯亮蓝更温和。使用 Ponceau S (CST #59803) 可以按以下方式使用:总蛋白经过电转移到膜上后,在 ddH2O中短暂冲洗膜,室温下在 Ponceau S 染色液中孵育膜 5~10 分钟,然后在 ddH2O 中冲洗膜 1~5 分钟,直至可见红色条带。然后可以用 1X TBS-T 冲洗五分钟,然后在冲洗膜之前对条带进行标记或拍照。之后可以继续进行实验,并且Ponceau S 的所有残留物会在封闭步骤中被洗去 。此外,Ponceau S 不会与抗体结合相互作用。
总体而言,两种实验步骤都可以帮助确保您的结果。 如果您需要检测 50-200 ng 范围内的蛋白质,则考马斯亮蓝是您的最佳选择。但是,在 CST,我们通常首.选Ponceau S,因为它速度快、易用、柔和而有效。
其他资源,供您学习:
CST 博 士 互 助 平 台
扫码关注CST博士互助平台,获得更多信号通路、实验技巧、科学前沿、商家活动等一手资讯。

