早在1976年,德国科学家Frieden Stein和他的同事在骨髓中发现了间充质干细胞(MSCs),后来的研究者发现间充质干细胞(Mesenchymal Stem Cell,MSC)是一种具有自我更新能力和多向分化潜能的成体干细胞,在特定的诱导条件下,能够分化成不同类型的细胞,包括成骨细胞、脂肪细胞、软骨细胞、肌细胞、神经细胞等,而且没有医学伦理的困扰,所以受到科学家的青睐,被广泛应用于组织再生、器官修复、血液病、癌症治疗等领域。
MSC的体外培养扩增不可避免地经历复制性衰老,伴随着基因组不稳定性,这是MSC细胞治疗行业一个严重的障碍。此外,因为接种起始MSC细胞浓度不一样,即使经过相同的扩增代数,细胞的复制周期是不一致的,导致批次间生产的MSC细胞的稳定性差,这也是目前MSC细胞在治疗行业的一个瓶颈。 因此通过单一MSC细胞来源的稳定细胞株为提供可持续的、稳定的MSC细胞生产成为关键,可以助力MSC干细胞治疗行业的快速发展。
为什么要挑选MSC细胞的单克隆细胞株?
细胞单克隆性,一般指用于建立最初的种子库细胞为单个细胞来源。药物生产过程中,具有单克隆源性的细胞库能够更好地保持产品批次之间的质量一致性,因此在三级细胞库建立过程中细胞的来源一致性尤为重要;这一点也是预防种子库细胞变异的风险的关键,也可更好的对上游工艺开发和下游产品质量的把控。
相反的,多克隆细胞系构建成功后不同细胞克隆生长速度不一致,目的基因表达量比较低的细胞克隆增殖速度一般更快,因此在最初的10代左右会观察到表达量逐渐下降,且不能长期维持细胞表型。
考虑到产品安全性,FDA的政策和法规都要求生物制药企业提供清晰图片证据,用以证明生产用的细胞株的单克隆源性。
本文详细介绍了利用Cytena公司开发的单细胞打印技术(SCP technology),通过将单个的MSC细胞自动分离到标准的96/384孔板中,大大加速MSC单克隆细胞株的开发。
材料与方法
1、细胞类型:贴壁的间充质干细胞(Mesenchymal Stem Cell,MSC)。
2、样品处理方法:
1) 用胰酶消化处理MSC细胞,变成悬浮细胞;
2) 用biosharp DMEM低糖培养基清洗重悬细胞,用40 μm的筛网过滤样品,去除细胞团块;
3) 按照7E5cells/ml的密度,将细胞加入一次性的分选芯片中。
3、分选工具:德国Cytena单细胞打印机F.SIGHT 2.0和一次性Catridge
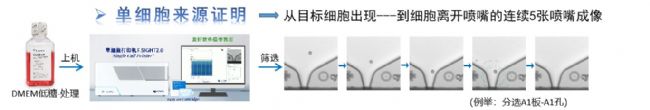
图1:克隆筛选单细胞打印系统分选流程图(single-cell printer™,scp™)
结果
表1是通过SCPTM和手动-LD方法分选的多块96孔细胞培养板的统计结果,我们可以发现SCPTM分选的D0单细胞率是手动-LD的4倍,在培养15天后统计“单克隆率”发现是手动-LD的3.67倍之多(表2)!
表1:MSC细胞单细胞率统计表
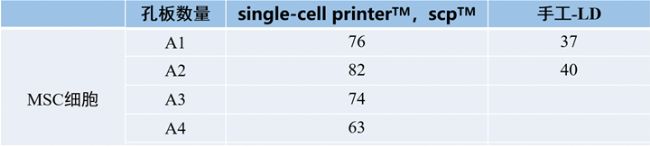
由于MSC细胞是贴壁细胞,细胞的结团率比较高,所以MSC的单细胞率不像悬浮类细胞的高(CHO单细胞率可以达95%以上),但是相比于平行的有限稀释法来说,单细胞率也提高了近4倍,提高了单克隆的筛选效率。
表2:MSC细胞单克隆率统计表

采用一次性的**的微流控芯片进行单细胞分选,每次只产生约150pL的液滴,单细胞率高。无菌的一次性的芯片可以避免项目之间的交叉污染,设备无需清洗和验证,有利于日后项目的申报审批。
图2:微流控**Cartridge芯片(150pL/单液滴体积)
讨论单细胞率是决定单克隆率高低的关键性因素,因此为寻求最适MSC贴壁样品筛选条件,我们做了以下测试:
板A1-3筛选圆度范围为0.5-1,板A4缩小圆度范围为0.7-1,直径范围均为15-25μm。
表1中“手工-LD”部分结果包括多克隆团,因此表2中 LD方法“D15单克隆率 < 20%”。
Cytena克隆筛选单细胞打印系统(single-cell printer™,scp™)采用**的芯片,能温和、高效、快速的分选,既保证了D0高的单细胞率,又结合了高分辨率的光学系统,留下单细胞分选的“印迹”,通过设置细胞的直径、细胞圆度、细胞荧光强度等质控方式,分选出“强壮”的细胞,利于后期克隆恢复,获得高的单克隆率。
结论SCPTM所获得贴壁的MSC单克隆率是手工-LD的3.67倍多!分选条件设置为:圆度范围在0.5-1,直径范围在15-25μm,更适合于MSC样品的单细胞筛选!这也说明了SCPTM可以很好的应用于MSC单克隆细胞株的筛选,助力于MSC细胞在细胞治疗、基因治疗、组织工程以及再生医学等领域的发展!
