
2020年10月18日,由国家癌症中心中国医学科学院肿瘤医院、中国食品药品检定研究院、中国抗癌协会肿瘤病理专业委员会共同发起的中国TMB标准化项目启动会在北京成功举行。项目的发起人中国医学科学院肿瘤医院病理科主任应建明教授在会上为“中国TMB标准化项目” 整体介绍并正式宣布该项目启动,工作组专家黄杰研究员、叶凯教授、李程教授、张绪超所长分别就项目的标品质控评估、临床质控评估、生信分析评估内容及统计方法、临床解读评估及可复用的分析评估平台等各个部分做了详细和精彩的讲解。
2020年6月,肿瘤突变负荷(Tumor Mutation Burden, TMB)获得了FDA伴随诊断批准,批准了不可切除或转移性的肿瘤组织样本突变负荷高(TMB-H)≥10个突变/Mb的成人和儿童实体瘤患者(既往治疗后疾病进展且没有更佳替代疗法),可以使用帕博利珠单抗单药治疗。这使得TMB成为继MSI/dMMR之后第二个肿瘤免疫治疗泛癌种伴随诊断标志物,同时也是第三个不需要考虑肿瘤器官来源的泛癌种标志物。同时,TMB检测中的各种问题变得亟待解决,由美国及欧洲的两个机构FoCR (Friends of Cancer Research)和QuIP (Quality in Pathology) 发起的TMB一致性评价项目更多进入了人们的视野。而中国TMB标准化项目相比于美国及欧洲的两个机构FoCR和QuiP项目,是目前全球范围规模最大的TMB标准化项目。
中国TMB标准化项目的第一阶段主要通过运用参考品(细胞系和临床样品)的高深度WES测序数据对目前国内大Panel产品进行全面的考察和评估,并建立大Panel检测(包括但不限于TMB)的标准化评估方法和可复用的云计算评估体系;项目的第二阶段将应用临床试验样本,结合高质量的临床及随访数据,运用WES划定不同癌种在免疫治疗下的TMB最佳获益基线,并以此为标尺来建立TMB临床大Panel检测产品的临床解读标准体系。
作为全球领/先的标准品研发生产商,菁良基因也很荣幸参与到次项目中来,为中国TMB标准化、规范化体系的建立与推动贡献自己的力量!为中国基因检测行业的发展添砖加瓦!
菁良基因在标准品研发生产方面有着先进的技术和丰富的经验,在进行标准品研发设计和生产的过程中,充分调研了行业现状及问题,严格遵守相关法规及政策,积极为行业提供优质的产品和解决方案。菁良基因自成立起,就积极推进行业标准化及规范化的工作,以建立基因检测行业的金标准,提高基因检测的准确性,助力于患者的精准治疗为目标。
菁良解决方案
为了推动TMB这一生物标志物的研究,促进行业标准化规范化,菁良推出的全球首创TMB质控品能够更好地帮助IVD企业进行流程质控、试剂盒性能确认及产品注册报证等。
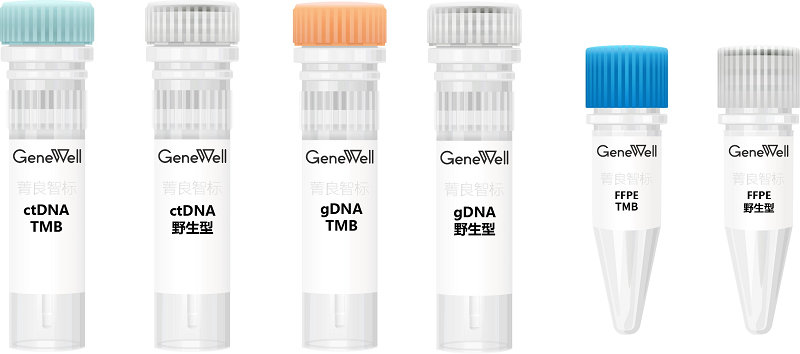
产品特点
▷ 细胞来源的标准品高度模拟病人样本
▷ 提供肿瘤来源细胞系及正常组织来源细胞系的配对样本
▷ 产品形式丰富:gDNA、ctDNA、FFPE
▷ 经过多家行业顶/级检测公司测试,结果稳定一致
▷ 提供标准品、配套完整WES数据、TMB分析流程及TMB参考值
▷ TMB值包含从3到26多个梯度
▷ 使用ddPCR验证tumor和normal cell的比例
更多产品信息
可点击“www.gene-well.com”获取
