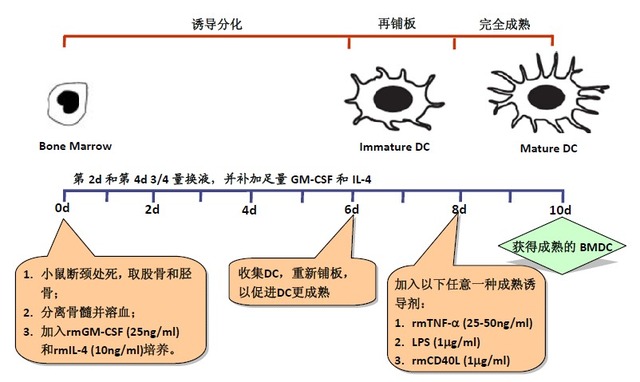
【经典的 BMDC 制备方法简图】
DC 是「Dendritic Cells」的缩写,中文全称为「树突状细胞」,因其成熟时伸出许多树突样或伪足样突起而得名。DC是由2011年诺贝尔奖获得者、加拿大 籍科学家 Ralph M.Steinman于1973年发现的[1],是目前发现的功能最强的抗原递呈细胞(Antigen Presenting Cells, APC)。已证实,DC是唯一能够显著刺激初始T细胞(Naïve T cells)增殖的APC,而其它种类的APC(如单核巨噬细胞,B细胞等)仅能刺激已活化的或记忆性的T 细胞,因此DC是机体适应性T细胞免疫应答的始动者,在肿瘤免疫中也发挥着极其重要的作用。
虽然DC存在于体内多种组织中,但含量很少,无法满足科学研究和临床治疗的需要, 所以人们尝试多种方法来体外培养和扩增DC。对于人,最常用的方法是从人外周血单个核细胞(PBMC)诱导DC的产生。而对于小鼠,最常见的方法是从骨髓细胞诱导产生DC,即骨髓来源的DC(Bone Marrow-Derived Dendritic Cells,BMDC)。
鉴于功能分析和分子生物学研究的需要,获得更高数量和更高纯度的BMDC是大家一直追求的目标,本文将与大家分享BMDC的经典制备方法和大量制备法,大家可根据自身需要选择使用。
另外,我们还备有实用的BMDC培养操作视频(内部交流,非商用),因文件比较大,若需要,可通过我们的企业QQ(号码为:800053055)向我们索取发送。
【BMDC培养的发展简史】
1973年---加拿大籍科学家Raplph M.Steinman在美国洛克菲勒大学(Rockefeller University)工作时从小鼠外周淋巴器官(脾、淋巴结和派氏集合淋巴结)中首次鉴定出树突状细胞(Dendritic Cells, DC)[1].Steinman 也因此获得了2011年诺贝尔生理学或医学奖。
1992年---日本京都大学(Kyoto University)的Inaba在添加GM-CSF(粒细胞/巨噬细胞集 落刺激因子)的情况下,分别成功从小鼠血液和骨髓细胞体外诱导出大量的 DC[2,3].因此,Inaba被认为是小鼠DC体外培养的创立者,且Inaba法被称为小鼠BMDC培养的经典方法。
1. 这些工作均是在 Ralph M.Steinman的参与下完成的;
2. Inaba培养的BMDC来源于小鼠股骨和胫骨中的骨髓;
3. Inaba先用抗体+补体法去除骨髓中的淋巴细胞,以防淋巴细胞对BMDC培养的影响;
4. 在诱导分化过程中,为防止粒细胞的干扰,Inaba通过每2天轻摇培养板并3/4体积换液的方法来尽量去除粒细胞;
5. Inaba证实单用GM‐CSF通过6‐8天的培养,即可从骨髓细胞诱导得到 大量的 DC 细胞,而且混合淋巴细胞反应提示其为成熟的 DC 细胞;
6. 该法可从一个小鼠的骨髓中培养获得5‐7 x 106个DC细胞。
1994年---奥地利因斯布鲁克大学(University of Innsbruck)的Romani等发现GM-CSF和IL-4(白细胞介素 4)联合诱导,可从人血液 PBMC(外周血单个核细胞)制备出大量的DC,而GM-CSF单独诱导的效果不好[4].后来,科学家也将IL-4应用于小鼠BMDC的培养[5,6].
1999年----德国明斯特大学(University of Munster)的Labeur研究表明,单独用GM-CSF诱导的BMDC为未成熟DC(immature DC, iDC),GM-CSF和IL-4联合诱导出来的BMDC的成熟度居中,添加CD40L或LPS可进一步诱导DC完全成熟,即成熟 DC(mature DC, mDC)[7].
1999年---德国埃尔朗根大学(University of Erlangen)的Lutz开发出一种可获得超大量BMDC的方法,每只小鼠可获得的BMDC的数量Inaba 经典方法的50倍之多,达1-3 x108个DC细胞/小鼠[8].该法被DC研究者广泛认可和使用。
1. 骨髓不作任何预先处理;
2. 使用细菌培养皿(Petri Dish)替代细胞培养板;
3. 细胞的初始铺板密度低,为 2 x 105/ml;
4. 培养时间延长至10‐12天;
5.仍仅用GM‐CSF诱导,但第8天或第10天后减量使用;
6.第6天和第8天半量换液,但吸出的悬浮细胞离心后放回原板。
2002年---美国匹兹堡癌症研究院大学(University of Pittsburgh Cancer Institute(UPCI))的Son也研发出一种超大量BMDC培养方法,称为 bulk-culture method.该法每只小鼠可获得的BMDC的数量是Inaba经典方法的7-10倍,即3 – 4 x 107个BMDC,而且培养时间与Inaba经典方法相似,仅需7天[9].
1. 骨髓取出后仅溶血,不做任何其它处理;
2. 使用6孔培养板培养;
3. 培养过程中使用GM‐CSF+IL‐4联合诱导;
4. 培养的第4天和第7天补加足量的GM‐CSF和IL‐4;
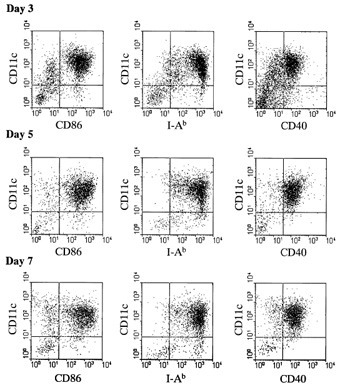
摘自文献 Son YI, et al. J Immunol Metods. 2002; 262(1-2): 145-57 [9]
【经典的BMDC培养法】-Inaba法(改良)[3,10]
¾ 背景:
1. Inaba法获得的BMDC数目为5-7 x 106个/小鼠;
2. Inaba原法操作比较复杂,需要将骨髓中的淋巴细胞等用抗体+补体法预先去除, 后来的改良法均省却了这个步骤,其实Inaba后来自己也说这个步骤虽然可提高BMDC的纯度,但不会对BMDC的生成产生影响,可做可不做 [10];
3. Inaba原法仅用GM-CSF来诱导BMDC的产生,虽然得到的BMDC在混合淋巴 细胞反应中有较强的刺激能力,但DC的成熟度不及GM+IL-4的联合诱导,所以后来的改良法中多用GM+IL-4联合诱导。
¾ 培养步骤:
1. 小鼠骨髓细胞的获得
1.1 小鼠(6-10周龄)颈椎脱臼法处死,手术取出所有股骨(femurs)和胫骨(tibias),并剪刀和镊子将骨周围的肌肉组织尽量去除干净;注:不要损伤到骨。
1.2 将骨移至超净台内,并用盛有70%酒精的无菌培养皿浸泡2-5 min,以消毒灭 菌,然后用无菌的PBS洗2次;
1.3 将骨移入另一个盛有PBS的新培养皿中,用剪刀剪去骨两端,再用注射器抽取PBS,针头分别从骨两端插入骨髓腔,反复冲洗出骨髓至培养皿中,直至骨完全变白;
1.4 收集骨髓悬液,用200目尼龙网滤去小碎片和肌肉组织;
1.5 滤过液1200rpm离心5 min,弃上清;
1.6 加入2 ml氯化铵红细胞裂解液(1x),重悬细胞,室温孵育 3-5 min,最长 10min;氯化铵红细胞裂解液的配制:
注:1)先配制10x 的贮存液,配法如下:称取 82.9 g NH4Cl,10.0 gKHCO3 和 0.37 g Na2EDTA,溶于1L的蒸馏 水中,0.22μm 滤膜过滤除菌,4oC储存6个月;注:可根据需要配制适量的10x 贮存液,其中各组分需成比例增减。
注:2)临用前,将10x 贮存液用无菌蒸馏水1:9稀释成1x 工作液即可。因氯化铵红细胞裂解液对骨髓细胞有一定的伤害作用,所以要尽量缩短溶血时间。
1.7 加入10ml PBS中和裂解液的作用,然后1200 rpm离心5 min,弃上清;
1.8 PBS洗1次,然后用含10% FBS的RPMI 1640培养液重悬细胞,至此已获得小鼠骨髓细胞。
2. BMDC的诱导分化
2.1 步骤1中获得的小鼠骨髓细胞计数后用含10% FBS 的RPMI 1640完全培养液调整细胞浓度为0.5-1x106/ml;
2.2 铺至24孔培养板内,每孔1 ml细胞,同时加入重组小鼠 GM-CSF(20 ng/ml)和IL-4(10 ng/ml),37℃,5% CO2培养箱培养,此为培养的第0天;
注:1) 一般一只小鼠大约可收获4-5 x 107个骨髓细胞,所以可以铺至少40-50个24孔板板孔。
2) GM-CSF和IL-4的使用浓度区间分别为20-50 ng/ml和10-40 ng/ml。
2.3 每2天轻轻摇晃培养板,然后3/4体积更换新鲜培养液,并补足细胞因子。
注:1) 此步骤的目的是去除粒细胞和淋巴细胞,因粒细胞和淋巴细胞为悬浮生 长;
2) Inaba 认为培养的前4天,大部分DC贴壁仍较牢,所以此法不会大量损失 DC;
3) 若发现损失的DC细胞过多,可仅在培养的第2天用此法换液;
4) 在培养的第4天,可以看到聚团生长的DC贴附于板底,第6天则可观察到很多DC成集落生长。
2.4 在第5天和第8天之间,轻柔吹打培养液,收集悬浮细胞及巯松贴壁生长的细 胞;
注:1) 最佳收集时间是培养的第6天;
2) 此时的细胞已经是BMDC,但成熟度不高,所以需要后续的再铺板(subculture)步骤使其更成熟;
3) 吸出培养液(含DC细胞)的24孔培养板需补充新鲜的含重组小鼠GM-CSF(20ng/ml)和IL-4(10 ng/ml)的 RPMI 完全培养液,继续培养, 以便后面能够再次收集BMDC。
2.5 1200 rpm离心5 min,弃上清;
2.6 用含10% FBS的RPMI 1640完全培养液重悬细胞并计数,然后调整细胞浓度 至1 x 106/ml,并加入重组小鼠GM-CSF(20ng/ml)和IL-4(10ng/ml);
2.7 细胞铺板至100 mm培养皿(每皿最多10ml)或6孔培养板(2m/孔)。
2.8 37℃,5% CO2培养箱继续培养1-2天;
2.9 收集悬浮细胞,即为较成熟的BMDC。
注:1) 第2.5-2.8步为再铺板(subculture)步骤,目的是使第2.4步获得的BMDC更加成熟。
2) 再铺板后的3 h内可见许多棘状贴壁细胞从DC簇中迁移出来,而培养1天后会发现这些贴壁细胞从培养板底脱离,而且可以看见在培养液中漂浮着许多典型的DC.
3. BMDC的完全成熟
注:步骤2中获得的BMDC并非完全成熟的DC,若想得到完成成熟的DC,还需LPS,CD40L或TNF-a等的诱导。
3.1 步骤2.4或2.9中获得的BMDC以1200rpm离心5 min,弃上清;
3.2 用含重组小鼠GM-CSF(20ng/ml)和IL-4(10ng/ml)的RPMI完全培养液重悬沉淀,计数后调整细胞浓度为1x106/ml;
3.3 加入24孔培养板中,并加入成熟诱导剂,如TNF-α(250U/ml),LPS(1μg/ml)、或 CD40L(1μg/ml)等;3.437℃,5% CO2培养箱培养2天;
3.5 收集悬浮细胞及疏松贴壁生长的细胞即为成熟树突状细胞。
【BMDC大量制备法】-Son法[9]
背景:
1. 该法可在7天内获得30-40x106个DC/小鼠,是Inaba 经典方法的7-10 倍。DC经14.5%甲泛葡胺(Metrizamide)梯度离心后,纯
度(即 CD11c+/I-Ab+ 细胞)可达85-95%.
2. 该法获得的DC的内吞能力弱于Inaba 经典方法,但分泌的IL-12p70量相似;
3. 该法获得的DC在混合淋巴细胞反应中比Inaba经典方法呈现更强的刺激能力;
4. 该法获得的DC能引起更强的特异性T细胞反应;
5. 以上结果提示,该法比经典方法能获得更多、更成熟的BMDC。
培养步骤:
1. 小鼠骨髓细胞的获得
见Inaba法(改良)中的相应步骤。
2. BMDC 的大量制备
2.1 步骤1中获得的小鼠骨髓细胞计数后用含 10% FBS的RPMI 1640完全培养液调整细胞浓度为 2 x 105/ml;
2.2 铺至6孔培养板内,每孔5 ml 细胞,同时加入重组小鼠GM-CSF(1000 U/ml)和IL-4(1000 U/ml),37℃,5% CO2 培养箱培养;
注:1)作者试探了125 U/ml、250 U/ml、500 U/ml 和 1000U/ml四个细胞因子浓度,发现浓度越低,BMDC细胞产量和成熟度越低,所以仍建议用1000 U/ml。
2) 笔者认为,1000 U/ml 是一个非常高的浓度,会导致培养成本过高。
2.3 在培养的第4天,向培养体系中补充重组小鼠 GM-CSF(1000 U/ml)和 IL-4(1000 U/ml); 注:向培养体系中直接补充细胞因子而不换液的目的是避免出现任何细胞损失,以获得最大量的DC.笔者认为,培养过程中必然会出现培养液发黄 的情况,如果不换液而只是添加细胞因子,细胞很快会因为营养不够而死亡。所以笔者建议在第4天和第7天时将培养液半量或3/4量吸出,离心后加入含足量GM-CSF和IL-4的新鲜培养液重悬细胞沉淀,然后再将 细胞放回至原板。
2.4 培养的第7天收集 DC,用2-4ml RPMI 1640完全培养液重悬,加至等体积的14.5%(w/v)甲泛葡胺上,1200 x g室温离心20 min。
注:此时的DC为不完全成熟的BMDC,要想进一步成熟,请跳至步骤 3。
2.5 收集中间层,并用RPMI 1640完全培养液洗3次备用。
3. BMDC 的完全成熟
3.1 步骤2.4中收集的 BMDC,重新铺板,并向培养体系中加入重组小鼠GM-CSF(1000 U/ml)和 IL-4(1000 U/ml),以及 LPS(1-10 μg/ml)
3.2 37℃,5% CO2培养箱培养 2 天,获得成熟的BMDC。
【BMDC大量制备法】-Lutz法[8]
¾ 背景:
1. Lutz法与Son法相似,均可大量制备BMDC,但与Son 法相比,Lutz法更为广泛地被采用,从以下两个方面可以得到印证:
1) 虽然Lutz法比Son法早发表3年(分别是1999年和2002年),但截至2015年12月,PubMed中已有633篇文献中引用Lutz法,而仅有24篇文献引用 Son法。
2) 在美国著名的学术社交平台:www.researchgate.net 上有一个交流帖,问:Does anyone have a protocol for generating dendritic cells from mouse bone marrow using GM-CSF? 回答者中大多数推荐和盛赞Lutz的BMDC培养法。
2. 该法可获得更多的 BMDC,达1-3 x 108 个/小鼠,而且纯度可达 90-95%;
3. 该法比Son法使用的细胞因子浓度低得多,仅为200 U/ml,而且培养的第8天到 第10天降为30-100 U/ml,这样可以大幅节约试剂成本;
4. 该法与Inaba经典方法和Son法的最大不同是使用细菌培养皿(Petri dish)而非细胞培养板来培养骨髓细胞。Inaba的解释是细菌培养皿不容易使骨髓中的巨噬 细胞贴壁,从而抑制巨噬细胞的发育,进而避免巨噬细胞对DC成熟的抑制作用, 这可能是该法能够以较低铺板密度获得大量 BMDC 的主要原因。
5. 但该法的培养时间较长,需要10-12天,一方面是为了获得更多的BMDC,另一 方面,大多数粒细胞和淋巴细胞很难存活这么长时间,因此可提高最终获得的BMDC的纯度;
6. 该法仅用GM-CSF进行诱导培养,得到的BMDC中未成熟和成熟DC均有,若 要进一步提高成熟度,需用LPS或TNF-α再诱导1-2 天,其中成熟DC细胞的含量将达到50-70%。
¾ 培养步骤:
1. 小鼠骨髓细胞的获得
见Inaba法(改良)中的相应步骤,注意省去溶血步骤。
2. BMDC 的大量制备
2.1 步骤1中获得的小鼠骨髓细胞计数后用含 10% FBS的RPMI 1640完全培养液调整细胞浓度为2 x 105/ml;
2.2 铺至100 mm细菌培养皿(Petri Dish) 中,每皿10 ml细胞,同时加入重组小鼠GM-CSF(200 U/ml,对于PeproTech的GM-CSF,相当于20 ng/ml),37℃,5% CO2培养箱培养;注:此处使用的是细菌培养皿,而非细胞培养板。
2.3 第3天时,向培养皿中再加入10 ml含20 ng/ml重组小鼠GM-CSF的完全培养液;
2.4 第6天和第8天分别半量换液,即收集旧培养液,离心后用含20 ng/ml重组小鼠GM-CSF的完全培养液重悬细胞沉淀,然后再将细胞悬液放回原皿;
2.5 第10天时可收集细胞,即为BMDC。
注:1)此时也可继续培养至第12天。若继续培养,可使用30-100 U/ml(即3 ng-10 ng/ml)的重组小鼠GM-CSF.
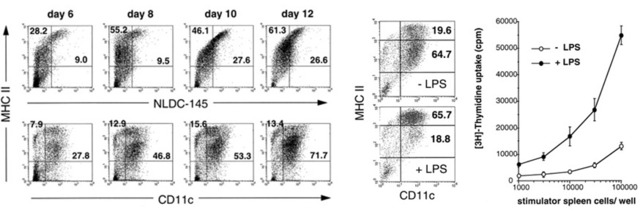
2)虽然培养时间越长,细胞表型上越成熟(CD11c的表达量高),但混合淋巴细胞反应实验显示,培养第8天和第10天收获的BMDC具有最强的刺激能力,而培养第12天的BMDC刺激能力明显减弱。
3)经过10天的培养,每皿平均可收获9.2 x 106个细胞。
3. BMDC的完全成熟
3.1 培养第10天的DC用移液器轻轻吹打收集悬浮细胞,300 x g室温离心5 min;
3.2 弃上清,用10 ml RPMI 1640完全培养液重悬细胞沉淀,然后铺于100 mm细胞培养板;注:此处不再用细菌培养皿,而是用细胞培养板,因 BMDC已形成,呈半悬浮状态,骨髓中残留的巨噬细胞前体虽然可贴附于细胞培养板,但不再会对DC的成熟起到抑制作用,反而会因为其贴于板底而使悬液中的DC的纯度更高。
3.3 加入重组小鼠GM-CSF(100 U/ml , 相当于PeproTech的10 ng/ml)和TNF-α(500 U/ml),或重组小鼠GM-CSF(100U/ml,相当于PeproTech 的10ng/ml)和LPS(1 μg/ml);
3.4 37℃,5% CO2培养箱继续培养1-2天。
【BMDC的鉴定】
1. 形态学观察:BMDC 多数呈集落生长,细胞有多个树突样突起,成熟的 BMDC 更加 明显;
2. 细胞表型分析:流式细胞术检测DC细胞表面 CD11c,CD40,CD80,CD86,MHC II类分子(I-A/I-E) 等的表达,BMDC高表达这些分子,完全成熟的BMDC中这些分子的表达会进一步提高。
3.混合淋巴细胞反应(MLR):BMDC具有较强的刺激能力,且成熟度越高,刺激能力越强。
摘自文献 Lutz MB, et al. J Immunol Metods. 1999; 223(1): 77-92 [8]
【注意事项】
1. 小鼠品系和性别:
多数研究表明,所使用的小鼠品系与获得 BMDC 的数量和成熟度关系不大[9],但也有研究表明C57BL/6小鼠可能更好。
Lutz表示从C57BL/10,DBA/2,C3 H/J和129等小鼠品系均可获得足够数量和纯 度的 BMDC,但 Lutz 在其实验中更倾向于使用 C57BL/6,ICR 和 BALB/c小鼠,且发现 C57BL/6 小鼠的BMDC产量最高,而且ICR小鼠和C57BL/6小鼠的BMDC对LPS 的成熟诱导敏感度高于BALB/c小鼠[8].
关于小鼠的性别,Inaba认为雄性小鼠更好些,因为他们的骨骼更大,从而可以获 得更多的前体细胞[10],但多数学者更倾向于使用雌性小鼠。
因此,目前培养BMDC用的比较多的小鼠是雌性或雄性C57BL/6小鼠。
2. 单独使用GM-CSF还是联合使用IL-4?
Inaba经典法和Lutz大量制备法中均仅用GM-CSF即可诱导出相当数量的 BMDC,而且也在混合淋巴细胞反应中表现出较强的刺激作用,但其实这些 BMDC的成熟度并不足够高。
研究显示,GM-CSF+IL-4联合诱导比GM-CSF单独诱导产生的BMDC表达更高的MHC II类分子和共刺激分子CD80和CD86等,提示前者具有更强的抗原递呈能力,而且前者在混合淋巴细胞反应中表现出更有效的刺激能力[5,7].在动物实验中也发现,GM-CSF+IL-4 联合诱导的BMDC可产生保护性抗肿瘤免疫反应,而GM-CSF单独诱导的BMDC的保护性较弱 [6],这些都说明 GM-CSF+IL-4联合诱导的BMDC的成熟度高于GM-CSF单独诱导的BMDC.
德国明斯特大学(University of Munster)的Labeur研究也表明,单独用GM-CSF诱导的BMDC为未成熟DC,GM-CSF和IL-4联合诱导产生的BMDC 的成熟度居中,添加CD40L或LPS可进一步诱导BMDC完全成熟 [7].
因此笔者认为,要想获得功能更好的BMDC,最好用GM-CSF和IL-4联合诱导骨髓细胞。而且,如果能在Inaba经典法和Lutz大量制备法中添加IL-4,应该会获得更加成熟、有效的BMDC.
3. 成熟诱导剂的选择
LPS,CD40L和TNF-α无论对人DC还是小鼠DC均是常用、有效的成熟诱导剂,那么应该选择哪个呢?
TNF-a 诱导DC的成熟能力在三者中最弱[7,8].LPS 和 CD40L均是DC体外完全成熟的强诱导剂,两者诱导DC的成熟度相似,但诱导产生的细胞因子谱有差异。CD40L诱导成熟的BMDC在体内显示出最强的免疫调节能力,包括保护性和治疗性肿瘤免疫反应的产生[7].
用LPS刺激DC完全成熟所用的浓度一般为 1-10μg/ml,但其实0.1 μg/ml已经有非 常强的作用,但保险起见,一般选用1 μg/ml。
对于CD40L需要注意的是,CD40L分子属于TNF配体家族,该家族的特点是在形 成三聚体后才能发挥作用。所以最好能用重组的CD40L三聚体蛋白来刺激DC,这样会有很好的效果。如果用CD40L单体来刺激DC,多数情况下成熟度并不是很高。
4. 培养方法的选择
本文列出迄今为止最常用的三种BMDC培养方法,我们从下表中可以更清楚地看出这三种方法的异同,相信您能根据您的需要作出正确的判断。
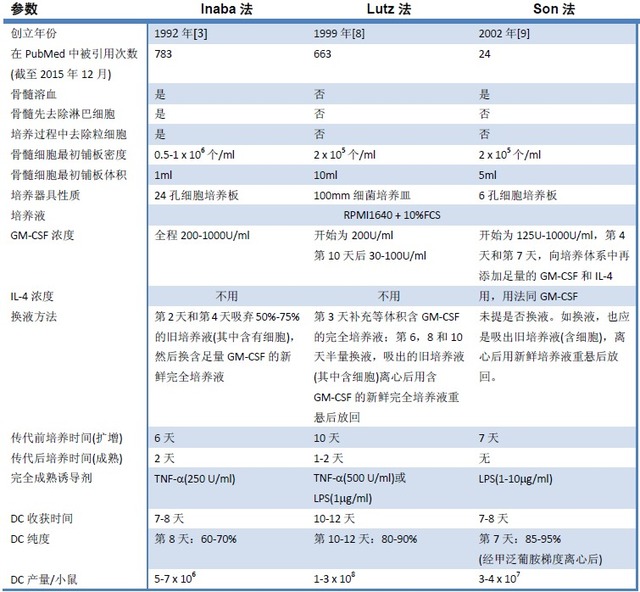
注:1. 该表是从文献[8]修改和添加而来;
2. 这里的Inaba法指的是其原法[2],而不是本文中的改良法。
【BMDC 培养试剂推荐】
| 生产商 | 产品名称 | 产品编号 | 产品规格 | 使用浓度 |
| PeproTech | 重组小鼠 GM-CSF | 315-03 | 5μg/20μg/50μg/100μg/250μg/500μg/1mg | 25-50ng/ml |
| PeproTech | 重组小鼠 IL-4 | 214-14 | 5μg/20μg/50μg/100μg/250μg/500μg/1mg | 10-40ng/ml |
| PeproTech | 重组小鼠 TNF-α | 315-01A | 5μg/20μg/50μg/100μg/250μg/500μg/1mg | 25-50ng/ml |
| PeproTech | 重组小鼠 sCD40L | 315-15 | 5μg/25μg/100μg/250μg/500μg/1mg | 1μg/ml |
【BMDC 鉴定试剂推荐】
| 生产商 | 产品名称 | 产品编号 | 克隆号 | 荧光标记 | 产品规格 |
| PeproTech(BioGems) | 抗小鼠 CD11c荧光标记抗体 | 3212 | N418 | FITC/PE/APC/PerCP-Cy5.5 /APC-Cy7/PE-Cy7 | 25μg/100μg/500μg |
| 抗小鼠 CD40荧光标记抗体 | 2512 | HM40-3 | FITC | 50μg/100μg/500μg/1000μg | |
| 抗小鼠 CD80荧光标记抗体 | 2912 | 16-10A1 | FITC/PE/APC | 25μg/100μg/500μg | |
| 抗小鼠 CD86荧光标记抗体 | 8912 | GL-1 | FITC/PE/APC/PE-Cy7 | 25μg/100μg/500μg | |
| 抗小鼠 MHC II类分子(I-A/I-E)荧光标记抗体 | 86212 | M5/114.15.2 | FITC/PE/APC/PE-Cy7 | 25μg/100μg/200μg /500μg |
注:用于DC鉴定的表面标志物的表达在流式图上均呈现单个峰,且多数情况下不能与阴性峰完全区分开来。为避免多色分析时补偿调节不好导致结果的不准确性,建议最好用单标,最多用双标来做DC表面标志的分析,而且必须使用同型对照,而非空白细胞对照来 排除背景染色。
【参考文献】
[1] Steinman RM, Cohn ZA. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J. Exp. Med. 1973; 137 (5): 1142–62.
[2] Inaba K, Steinman RM, et. al. Identification of proliferating dendritic cell precursors in mouse blood. J. Exp. Med. 1992; 175(5):1157-67.
[3] Inaba K, Inaba M, et. al. Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor. J. Exp. Med. 1992; 176(6):1693-702.
[4] Romani N, Gruner S, et. al. Proliferating dendritic cell progenitors in human blood. J. Exp.
Med. 1994; 180(1):83-93.
[5] Zorina T, Mayordomo JI, et. al. Culture of dendritic cells from murine bone marrow supplemented with GM-CSF and TNF-alpha J. Immunother. 1994; 16(3):247.
[6] Mayordomo JI, Zorina T, et. al. Bone marrow-derived dendritic cells pulsed with synthetic tumour peptides elicit protective and therapeutic antitumour immunity. Nat Med. 1995;1(12):1297-302.
[7] Labeur MS, Roters B, et. al. Generation of tumor immunity by bone marrow-derived dendritic cells correlates with dendritic cell maturation stage. J Immunol. 1999;162(1):168-75.
[8] Lutz MB, Kukutsch N, et. al. An advanced culture method for generating large quantities of highly pure dendritic cells from mouse bone marrow. J Immunol Methods. 1999;223(1):77-92.
[9] Son YI, Egawa S, et. al. A novel bulk-culture method for generating mature dendritic cells from mouse bone marrow cells. J Immunol Methods. 2002; 262(1-2):145-57.
[10] Inaba, K., Romani, N., et al. Generation of dendritic cells from proliferating mouse bone marrow progenitors. In: Coico, R., Ranz, A., Kruisbeek,A.M. (Eds.), Current Protocols in Immunology.Wiley, New York. 1998; Unit 3.7.
