前言
长骨节段性缺损较难愈合一直是阻碍骨再生医学发展的重要问题。重组蛋白临床应用价格昂贵且用量多副作用大,已经不能满足日益提高的医疗需求。美国梅奥康复医学中心联合MERLN创新再生医学研究所的团队近日在Science Advances发表了题为‘Efficient healing of large osseous segmental defects using optimized chemically modified messenger RNA encoding BMP-2’的文章。文中应用通过化学修饰的mRNA替代重组蛋白递送到大鼠骨折部位促进骨重建再生,为骨愈合治疗提供了一种创新、安全、可转化的技术。
背景介绍
骨形态发生蛋白(bone morphogenetic protein,BMP),是一组具有类似结构的高度保守的功能蛋白,属于TGF-β家族。BMP能刺激DNA的合成和细胞的复制,促进MSCs定向分化为成骨细胞。它还是体内诱导骨和软骨形成的主要因子,并在肢体生长、骨折早期、软骨修复时表达,对骨骼的发育和再生修复起到重要作用。
再生医学为修复骨缺损和产生再生骨提供了新的解决方案。重组人骨形态发生蛋白-2(rhBMP-2)等重组蛋白类新药已被批准在美国使用,但该类新药展现出的治疗效果却差强人意。寻找一种高效安全的局部基因递送方法成为更具有前景的研究思路。
mRNA是基因和其编码蛋白之间的媒介。与DNA疗法不同,不存在插入突变或其他遗传损伤的风险。编码特异性治疗蛋白的合成mRNA容易制备,并且可以通过廉价的非病毒载体递送到细胞内。但mRNA的不稳定性、细胞毒性和炎症特性阻碍了其在再生医学中的应用,对mRNA进行结构修饰和脂质载体递送同样也是目前研究重点。
文章中研究者评估了一种化学修饰的mRNA(cmRNA)编码的BMP-2修复大鼠股骨严重节段性缺损的能力。新生骨显示出与天然骨相当的力学性能,且没有重组蛋白使用后形成的大量骨痂。该研究提示了转录疗法在加速骨愈合方面的有效性和安全性。
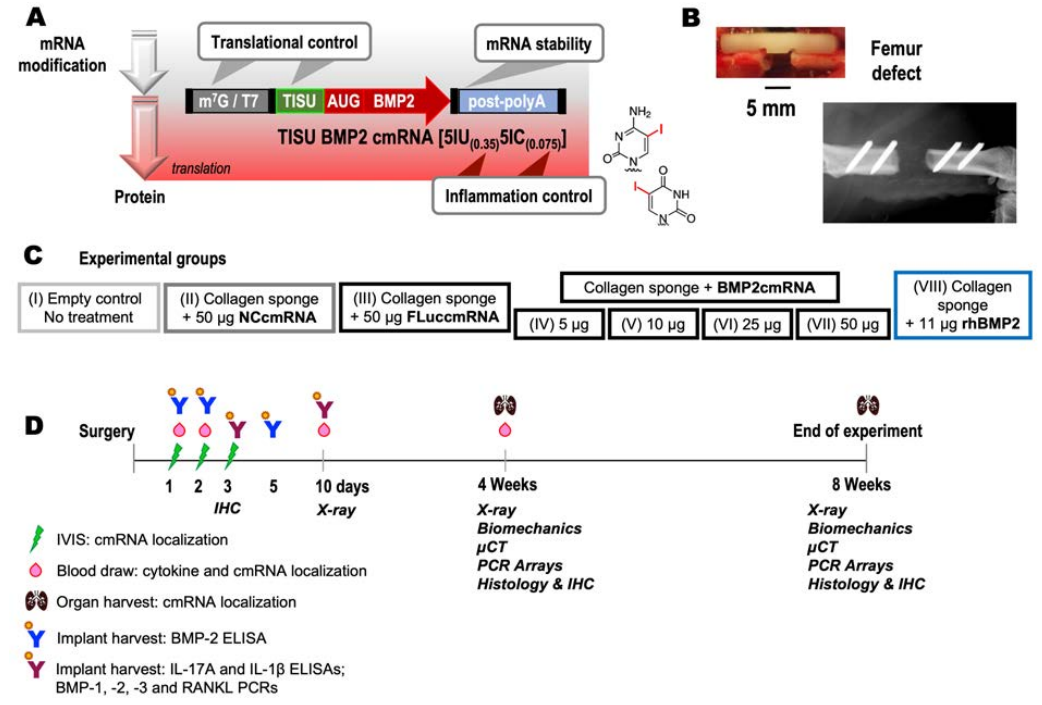
研究内容
01
为了研究化学修饰的mRNA(cmRNA)的安全性和体内药物代谢,研究者对中段骨缺损的大鼠原位注射了携带萤火虫荧光素酶Fluc的cmRNA并进行活体成像,在除治疗部位外的其他身体部位未观察到荧光。给予cmRNA治疗后,体内产生大量的BMP-2蛋白,注射后第5天,蛋白质表达衰减至低水平。相比之下,应用重组人BMP-2蛋白在第1天达到高点后就开始逐渐减弱。该研究提示局部应用cmRNA的可行性及cmRNA药物代谢的优势。
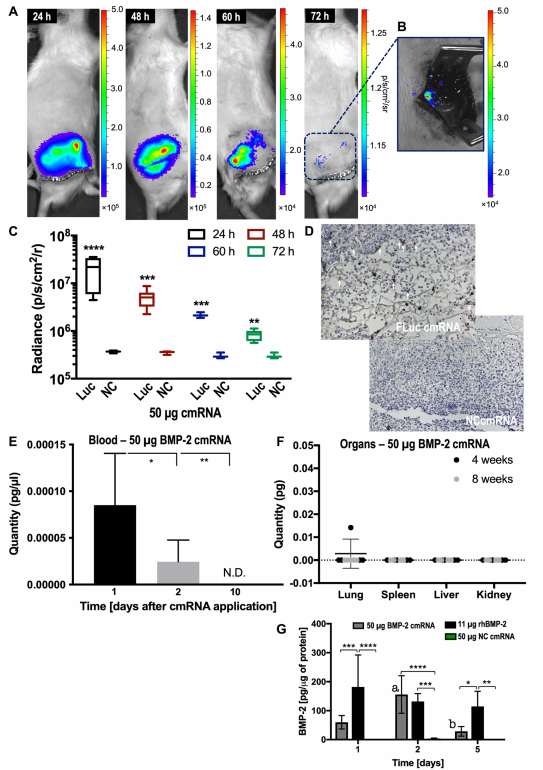
Figure 1. Single application of FLuc cmRNA induces robust and localized luciferase activity in the bone but is absent from the circulation and essential organs.
02
研究者接下来对cmRNA应用的剂量依赖性进行了探究。当原位给予25ug及以上的cmRNA时产生的BMP-2蛋白能够愈合骨缺损。给药4周后,25ug的cmRNA剂量下骨愈合率为50%,50ug的剂量下动物骨缺损完全愈合。并且在使用cmRNA的愈合过程中,未观察到rhBMP-2引起的大量异位骨痂形成。μCT结果显示cmRNA组和rhBMP-2组新生骨小梁更薄,骨小梁厚度、数量和骨小梁分离度均相似。rhBMP-2组在治疗4-8周过程中存在骨丢失加速的现象,而cmRNA组则表现稳定。提示了应用cmRNA治疗的可取性。
在力学方面,愈合会恢复长骨的失效扭矩值。cmRNA组在治疗4周时恢复了天然骨的失效扭矩值,而此时rhBMP-2组的失效扭矩值仍然显著低于正常。8周时,仅cmRNA组的失效扭矩显著高于正常骨组。这表明cmRNA的作用可能使骨机械强度恢复更快。
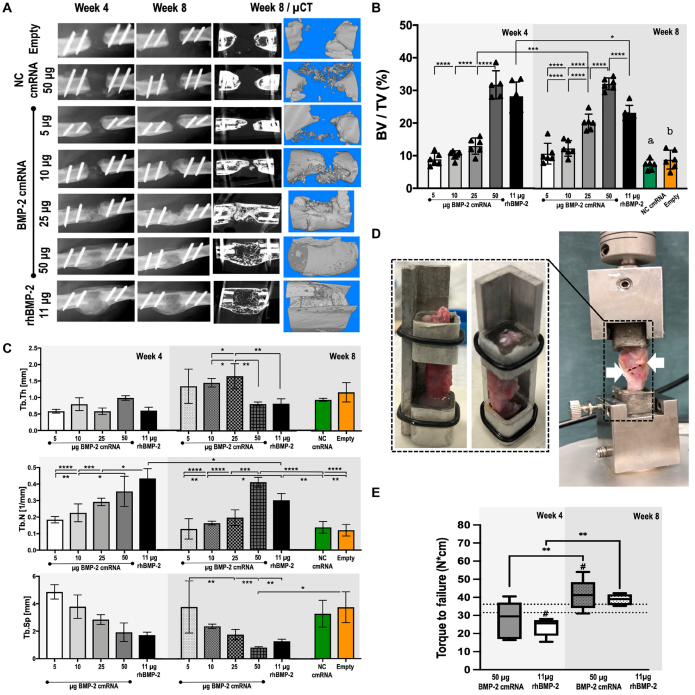
Figure 2. Bone healing with BMP-2 cmRNA is dose-dependent; doses >25ug are necessary to heal critically sized bone defects reliably in rats.
03
研究者应用PCR芯片对cmRNA及rhBMP-2影响的成骨和基质形成相关基因进行了批量检测,结果显示二者均刺激了骨细胞外基质关键成分胶原、骨连接蛋白及转化生长因子等转录本上调。同时参与骨重塑的酶如基质金属蛋白酶和组织蛋白酶K也上调,提示骨缺陷修复过程中矿化组织环境的高度活跃。而只有cmRNA影响II型和X型胶原的转录本。II型胶原是软骨细胞的标志,X型胶原是软骨细胞肥大和软骨内骨化的标志。因此治疗方式的不同会导致骨愈合过程的差异,cmRNA引起软骨内骨化,rhBMP-2引起膜内骨化。
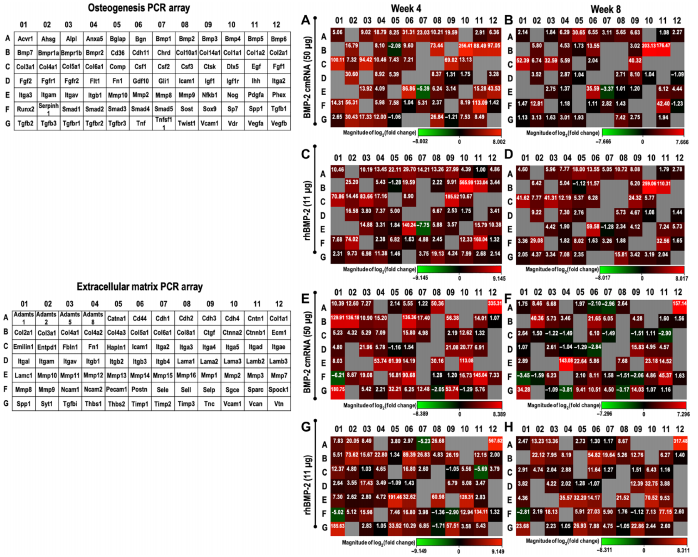
Figure 3. Expression of relevant osteogenic and extracellular matrix–related genes in newly formed tissue.
04
组织学检查证实cmRNA组和rhBMP-2组在4周和8周时骨缺损被桥接。Masson和HE染色均显示有皮质和骨髓重建的新骨生成。与cmRNA组相比,rhBMP-2组骨痂体积更大,皮质的修复却不明显,提示了cmRNA应用的安全性更好。cmRNA在较低浓度时能够增强X型胶原的表达,并刺激间充质前体的软骨形成,但无法进一步促进软骨内成骨。加大剂量到50ug后促进软骨内成骨继续到骨形成。cmRNA处理后TRAP阳性面积比显著增加,局部IL-17A和RANKL表达增加,表明与rhBMP-2相比,cmRNA治疗组织重塑效果更好。
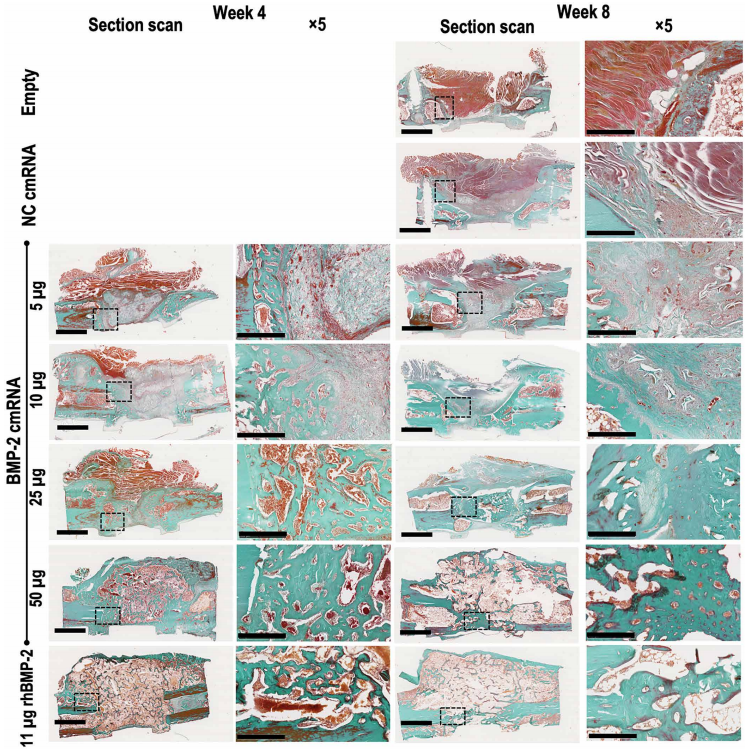
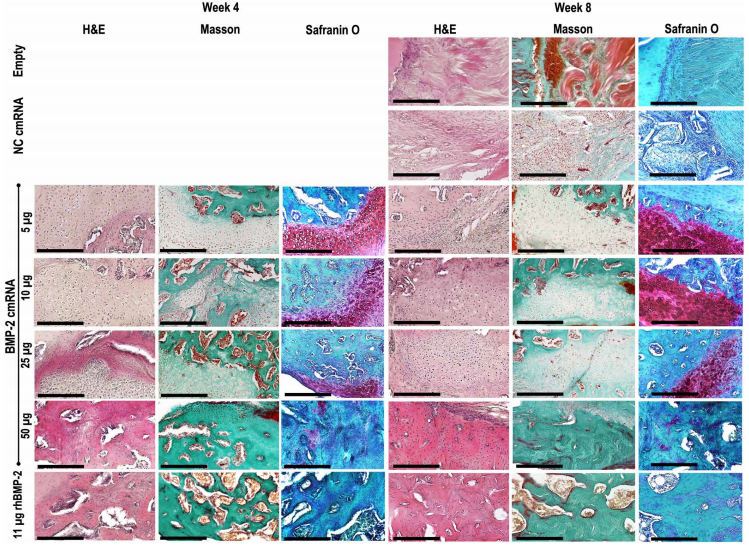
Figure 4. BMP-2 cmRNA administration induces de novo bone deposition in the defect.
05
研究者又通过免疫组化发现经cmRNA治疗骨缺损中存在II型和X型胶原。这些胶原的表达在低剂量cmRNA治疗的骨缺损组别中最高。而II型胶原在50ug cmRNA治疗后期的缺损中已不可见,推测是因为足量cmRNA加快软骨内骨化修复。低剂量应用cmRNA治疗后X型胶原的表达弱于II型胶原,无法继续促进软骨内骨化。经50ug cmRNA处理的缺损在4周时X型胶原已不明显,证明足量的cmRNA治疗产生的II型和X型胶原能够加快修复进程。
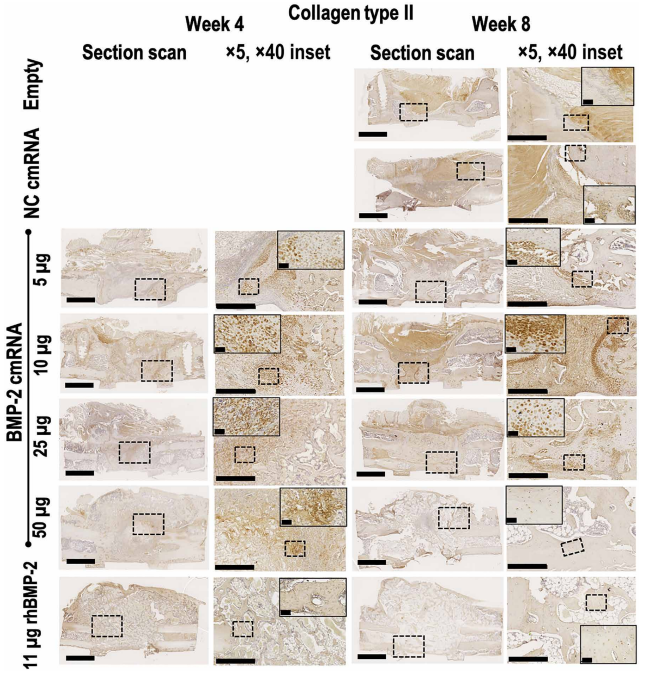
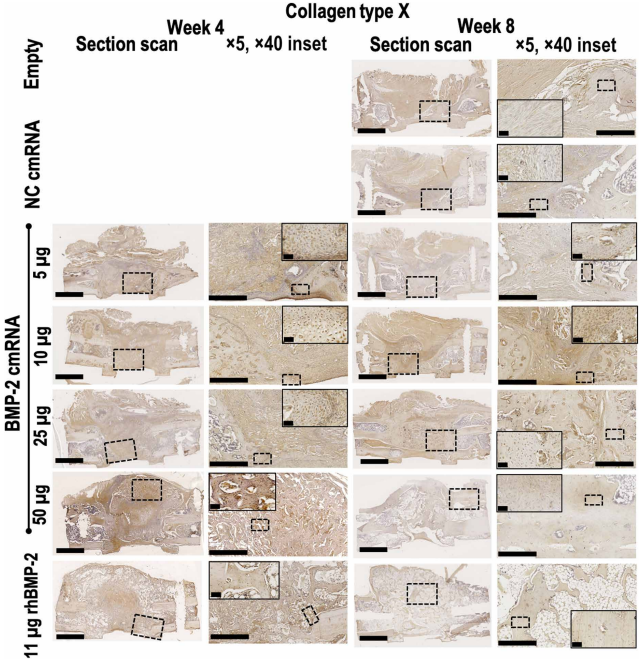
Figure 5. Collagen type II deposition and chondrocytic cells are only visible within defects administered BMP-2 cmRNA,Collagen type X is clearly visible 4 weeks after BMP-2 cmRNA treatment but decreases at 8 weeks.
06
为了评估骨缺损治疗中局部炎症因子产生情况,研究者在手术和应用cmRNA或rhBMP-2后的不同时间,测定外周血中各种炎症因子、肿瘤坏死因子及抗炎因子的浓度。模型组和rhBMP-2治疗组没有发现细胞因子的增加。而在cmRNA治疗组中,细胞因子水平显著升高。单独使用非编码cmRNA会增加细胞因子的产生。当使用目的基因的cmRNA时,诱导炎症作用进一步增强。其中对促炎细胞因子IL-1a的诱导作用特别强。而对照cmRNA组诱导炎症的水平在第1天较低,所有组别细胞因子升高均在术后1天达到峰值,并持续至少10天。
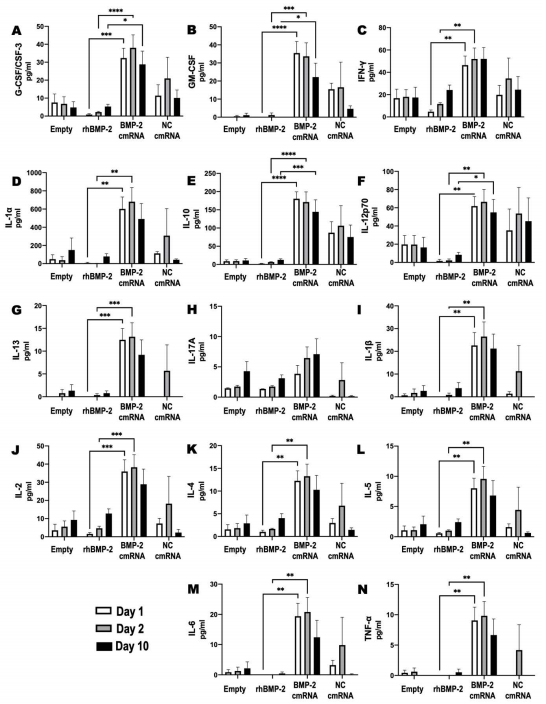
Figure 6. Circulating cytokines elevated as a result of cmRNA application.
和元生物具有多年丰富的动物实验和代谢疾病动物模型构建的实操经验,并兼具出色的基因操作与病毒构建等技术。同时依托公司的检测平台、病理平台、细胞平台等专业实验平台,可为您提供稳定的全身代谢疾病动物模型、动物监测、代谢组学、基因测序、病理检测、体外研究等一站式代谢疾病研究服务体系,您可体验文中涉及到的前沿研究手段与支持。欢迎关注和元公众号了解实验服务详情,和元生物期待您的到来。
