导读聚焦
本期绘谱导读聚焦饮食方式和饮食成分干预疾病的代谢机制研究,完美诠释了“You are what you eat”:
1. 饮食、肠道微生物与代谢性/炎性疾病
Cell Metabolism一篇论文发现限时喂养可改善脂肪性肝病,R. torques菌通过产生2-羟基-4-甲基戊酸抑制肠道HIF-2α-神经酰胺途径,其定植或口服该物质可改善MASH小鼠模型中的炎症和纤维化;Cell Host & Microbe一文从国人肥胖队列中筛选出致胖菌巨单胞菌,其降解肠道肌醇、促进脂质吸收导致肥胖发生;另一篇Cell Host & Microbe研究则揭示富含可溶性膳食纤维的饮食可增加拟杆菌门B. acidifaciens的丰度,减轻小鼠酒精性肝损伤;Gut一文表明母乳中花生四烯酸含量升高会引发婴儿肠道菌群失调且并发特应性皮炎。
2. 饮食及成分干预与肿瘤/细胞死亡
Cell主刊的一项研究揭示含两个多不饱和脂肪酰基的磷脂PC-PUFA2s与线粒体电子传递链相互作用,产生活性氧引发脂质过氧化,导致细胞铁死亡; Nature metabolism的一项研究发现生酮饮食增加小鼠的赖氨酸β-羟基丁基化Kbhb等整体水平,并证实ALDOB K108bhb抑制癌细胞mTOR信号通路和糖酵解过程,削弱癌细胞增殖;第三篇Cell Host & Microbe研究发现C. symbiosum通过产生BCAAs、触发胆固醇代谢和下游信号传导,促进结直肠肿瘤的发生和发展。Nature一文探讨了禁食状态下肝脏细胞重塑翻译组的过程与代谢程序及肿瘤发生的关联,为开发癌症治疗策略提供了新靶点。
导读目录
1. Cell Metabolism | 微生物代谢物通过抑制HIF-2α-神经酰胺途径来介导限时摄食对MASH的有益作用
2. Cell | 含两个多不饱和脂肪酰基的磷脂促进铁死亡
3. Gut | 母乳来源的花生四烯酸诱导的婴儿肠道生态失调与特应性皮炎发病的关系
4. Nature metabolism | 生酮饮食通过赖氨酸β-羟基丁基化重塑癌症代谢
5. Cell Host & Microbe | 巨单胞菌降解肌醇,增强脂质吸收从而促进肥胖
6. Cell Host & Microbe | 膳食纤维通过酸化拟杆菌和随后的氨解毒减轻酒精性肝损伤
7. Cell Host & Microbe | Clostridium symbiosum通过产生BCAA来调节宿主胆固醇代谢,从而促进结直肠肿瘤的发生
8. Nature | 翻译组重构控制饮食及其对肿瘤发生的影响
资源领取
本期导读文献原文,请在公众号后台回复“2024年8月绘谱导读”,即可获取资源链接。
01
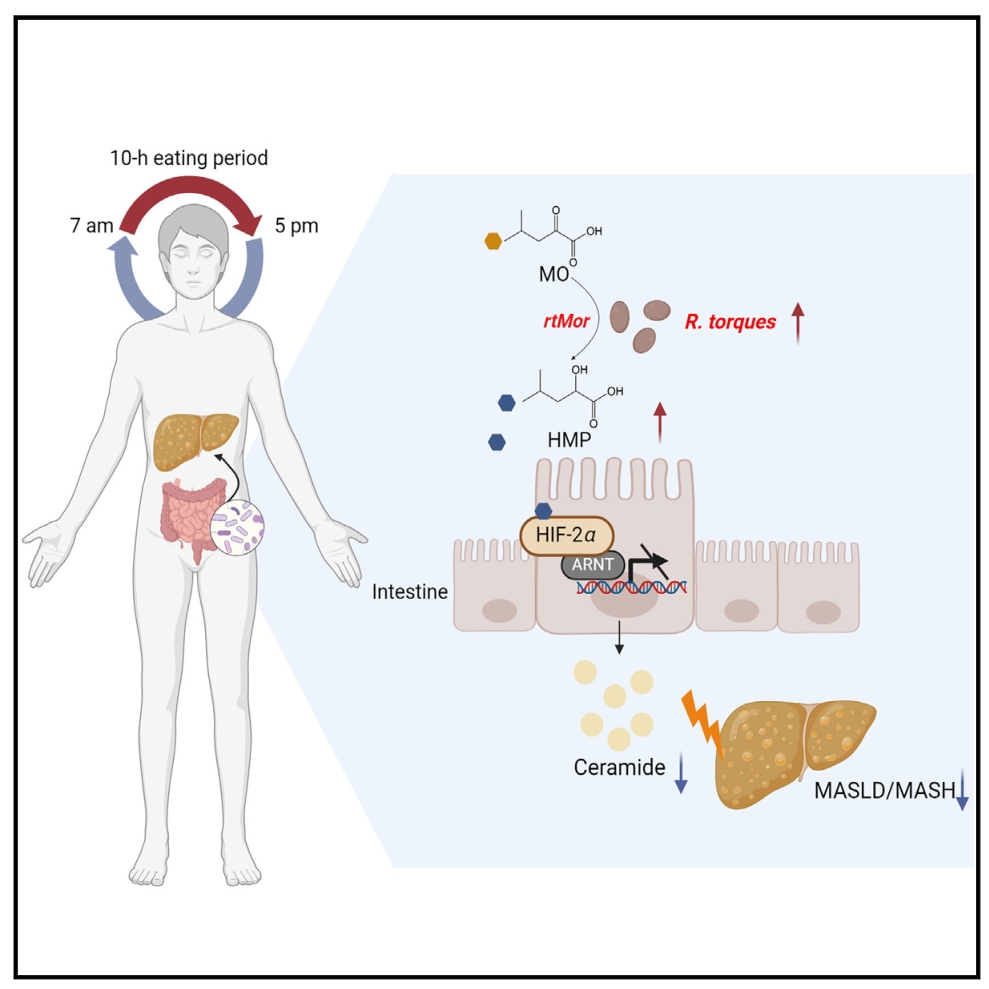
Cell Metabolism | 微生物代谢物通过抑制HIF-2α-神经酰胺途径来介导限时摄食对MASH的有益作用
限时喂养(TRF)是一种有效的饮食干预,可改善代谢疾病,包括代谢功能障碍相关的脂肪性肝病/脂肪性肝炎(MASLD/MASH)。然而,这种功效的机制仍难以完全阐明。本研究发现TRF改善了MASLD, R. torques菌通过产生2-羟基-4-甲基戊酸(HMP)抑制肠道HIF-2α-神经酰胺途径,证明了R. torques菌定植或口服HMP补充都可以改善MASH小鼠模型中的炎症和纤维化。
1. 对TRF处理前后收集的MASLD患者粪便样本进行了宏基因组测序,发现处理后R. torques菌的丰度显著增加。以HFD饮食诱导的MASLD小鼠模型为模型,TRF介导的改善作用被抗生素处理后被消除,并且TRF组R. torques菌的丰度明显增加,与人类样本的变化一致。
2. 通过RNA测序(RNA-seq)对R. torques菌灌胃小鼠和PBS灌胃小鼠的肠上皮细胞进行转录组分析,转录因子富集分析表明,缺氧诱导因子(HIF)-β (HIF-β,也称为ARNT)-和HIF-2α介导的转录激活可能在R. torques菌介导的MASLD代谢益处中发挥重要作用。
3. 脂质组学分析,神经酰胺水平在R. torques处理组下调,尤其是肠上皮中最丰富的神经酰胺(d18:1/16:0)。此外,R. torques处理组通过SMase途径和挽救途径抑制神经酰胺合成,但这一过程不影响新生和代谢途径。
这些发现确定了R. torques菌和HMP作为治疗代谢紊乱的潜在TRF模拟物。
参考文献
Zhang Y, et al. A microbial metabolite inhibits the HIF-2α-ceramide pathway to mediate the beneficial effects of time-restricted feeding on MASH. Cell Metab. 2024.
02
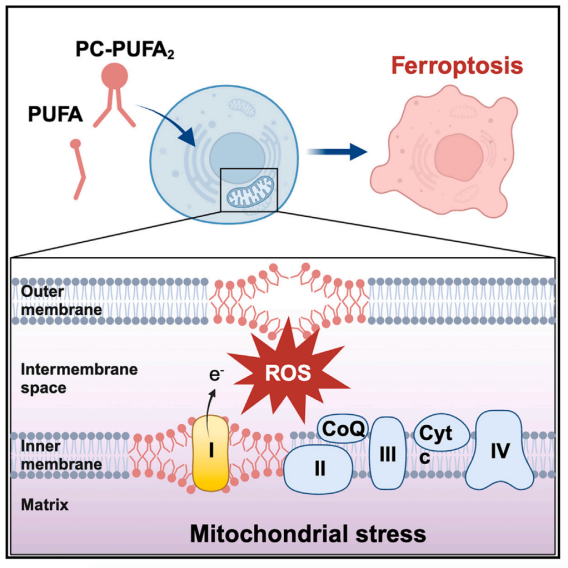
Cell | 含两个多不饱和脂肪酰基的磷脂促进铁死亡
磷脂(PLs)是构成细胞膜的脂质双分子层的基本组成部分,含有单一多不饱和脂肪酸酰基尾部的磷脂(PL-PUFA1s)会驱动铁死亡,而具有双酰基-PUFA尾部的磷脂(PL-PUFA2s)很少被研究。膳食脂质可调节铁死亡,但控制脂质代谢和铁死亡敏感性的机制尚不清楚。本研究揭示了脂肪酸或磷脂处理后PC-PUFA2s(二酰基-PUFA磷脂酰胆碱,属于PL-PUFA1s的一种)的显著积累,与癌细胞对铁死亡的敏感性相关。PC-PUFA2s与线粒体电子传递链相互作用,产生活性氧(ROS),引发脂质过氧化和细胞死亡。
1. 在培养中添加了不同种类的PL(磷脂),并测量了每种PL对细胞活力的影响,结果表明,其中磷脂酰胆碱(PCs)诱导铁死亡的效力和特异性最高,并且PC-PUFA2s表现出更高的铁死亡效力。靶向脂质组学发现,对铁死亡敏感的细胞系中PC-PUFA2s的丰度明显更高。
2. 靶向脂质组学发现,PC-PUFA2s处理的细胞中游离PUFAs的增加,游离PUFA和PC-PUFA1s可能是形成PC-PUFA2的前体,从而进一步引发铁死亡。当单独用PUFA处理(DHA或ARA处理)时,细胞中PC-PUFA2s显著增加。
3. 通过亲和力下拉(Pull-Down)试验结合质谱(MS)来鉴定PL结合的蛋白复合物,发现线粒体ETC复合物I在PL-PUFA2组中特异性富集。非酒精性脂肪性肝病和化学致癌-ROS途径在PL-PUFA2组富集,而过氧化物酶体途径在PLPUFA1组富集。
参考文献
Qiu B, et al. Phospholipids with two polyunsaturated fatty acyl tails promote ferroptosis. Cell. 2024.
03
Gut | 母乳来源的花生四烯酸诱导的婴儿肠道生态失调与特应性皮炎发病的关系
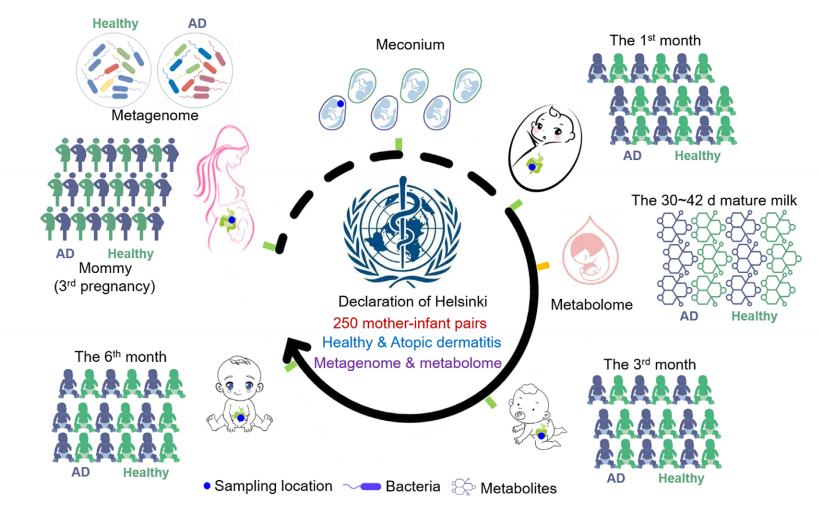
特应性皮炎(Atopic dermatitis, AD)是一种常见且慢性、炎症性、瘙痒性的皮肤病,婴儿AD多发于出生后6个月内,有研究表明肠道微生物群在AD的发展中起着关键作用,然而尚不清楚不同喂养方式,如母乳的衍生代谢物如何影响AD。本研究发现母乳中的花生四烯酸(Arachidonic acid,AA)含量会随着哺乳期的延长而升高,进而引发婴儿肠道菌群失调,且并发特应性皮炎,提示AD易感人群通过改善饮食习惯、调整肠道菌群平衡来降低患病风险。
1. 本研究招募了250对母婴,发现母乳喂养时间的减少与婴儿AD发病率的降低有关。收集产后30至42天的成熟乳样本进行非靶向代谢组学分析,对应收集了出生到6个月大的婴儿粪便及母体粪便进行宏基因组测序。联合分析表明母乳中高浓度的AA会导致婴儿肠道菌群失调。
2. 接下来对宏基因组数据进行深入分析,结果表明,四种特定细菌能够将甘露聚糖降解为甘露糖,从而增强了甘露聚糖依赖的O-抗原和脂多糖的生物合成。相关性分析证实,在患有AD的婴儿中,高AA浓度下大肠杆菌的丰度与某些微生物途径(GDP-甘露糖衍生的O-抗原和脂多糖生物合成)呈正相关。
3. 为了充分说明AA在皮肤炎症中的作用,使用小鼠模型进行研究。结果表明,AA破坏CD4/CD8细胞比例,增加皮肤损伤面积,提高外周Th2细胞比例,并在BALB/c小鼠中促进了IgE分泌以及前列腺素和白三烯的生物合成。
参考文献
Jiang S, Cai M, Li D, Chen X, et al. Association of breast milk-derived arachidonic acid-induced infant gut dysbiosis with the onset of atopic dermatitis. Gut. 2024.
04
Nature metabolism | 生酮饮食通过赖氨酸β-羟基丁基化重塑癌症代谢
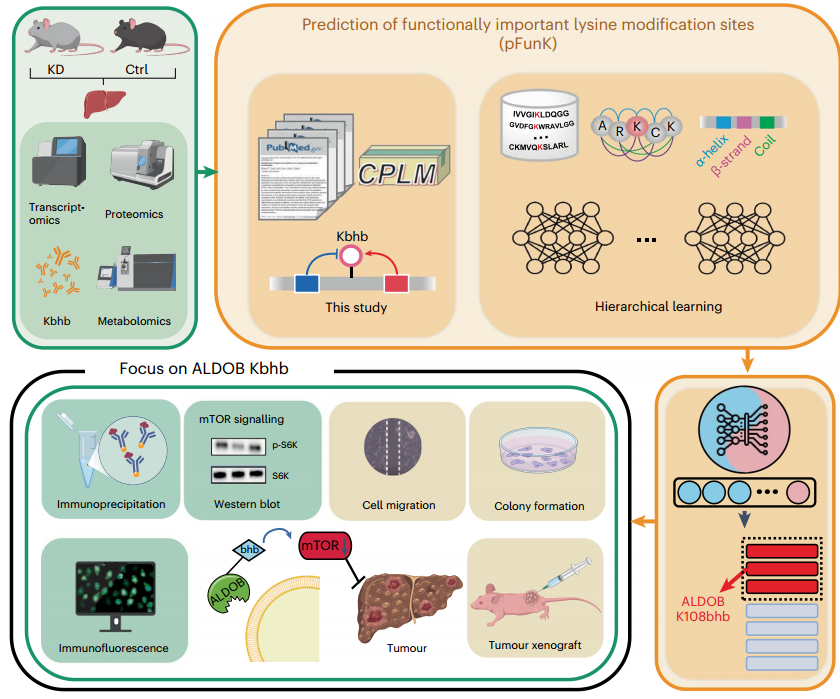
生酮饮食(KD)是一种高脂肪、极低碳水化合物和适量蛋白质的饮食方案,促进游离脂肪酸在肝脏中转化为酮体,对多种疾病具有治疗作用。赖氨酸β-羟基丁酰化(Kbhb)是由生酮饮食诱导的翻译后修饰,然而目前Kbhb对如何调节细胞过程知之甚少。本研究通过小鼠肝脏的多组学分析揭示了生酮饮食下Kbhb修饰发挥功能效应的新机制,揭示Kbhb如何影响肝细胞癌(HCC)及其他癌症。
1. 首先通过体内实验发现KD显著增加了小鼠的Kbhb、乙酰化(Kac)和O-糖基化(O-GlcNAcylation)的整体水平,其中Kbhb的增加最为显著。随后对小鼠肝脏样本进行了蛋白质组学、β-羟基丁酰化修饰组学、转录组学和代谢组学在内的多组学定量和分析。结果发现,差异调控的Kbhb位点主要富集在与肿瘤发生相关的脂肪酸和能量代谢过程中。
2. 研究者开发了新的分层学习框架pFunK模型用来识别功能性Kbhb位点。对鉴定到的5304个位点进行了打分和排序,预测出其中27个蛋白可能具有功能性,并对前六位的代谢酶进行了验证,其中包含糖酵解过程中的重要调节因子ALDOB K108Kbhb(K108位赖氨酸β-羟基丁酰化修饰)。
3. 随后,通过结合遗传密码子扩展技术、位点特异性抗体定制、免疫共沉淀等技术,发现生酮饮食能降低小鼠肝脏mTOR信号通路,且ALDOB K108bhb能降低与果糖1,6-二磷酸FBP的结合,从而降低mTOR信号通路。
4. 最后,研究者通过肿瘤细胞增殖实验、划痕实验、裸鼠皮下成瘤实验、qPCR实验、靶向代谢组学等手段,证明了ALDOB K108bhb抑制癌细胞mTOR信号通路和糖酵解过程,削弱了癌细胞增殖。
参考文献
Qin J, Huang X, Gou S, et al. Ketogenic diet reshapes cancer metabolism through lysine β-hydroxybutyrylation. Nat Metab. 2024.
05
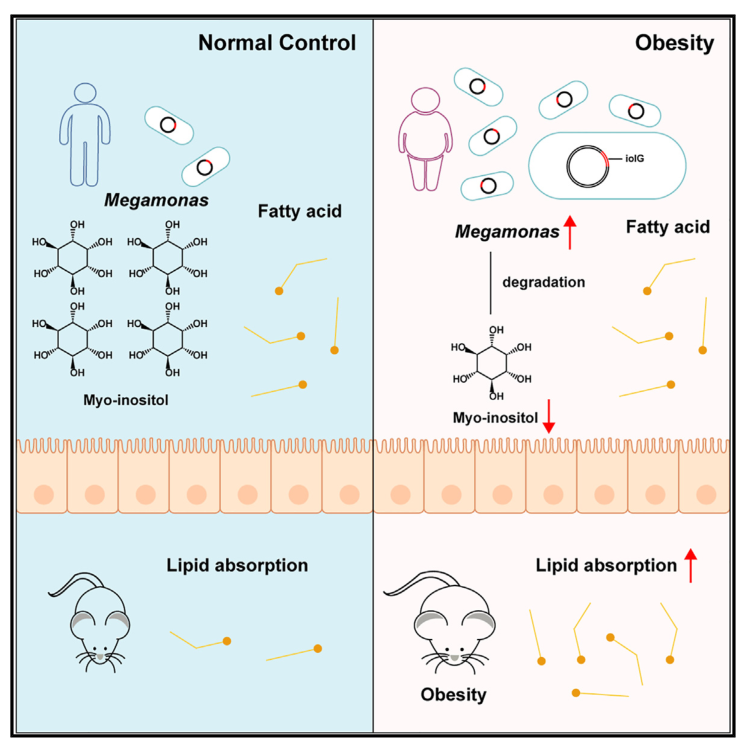
Cell Host & Microbe | 巨单胞菌降解肌醇,增强脂质吸收从而促进肥胖
肥胖是一种由遗传和环境因素引起的多因素疾病,许多研究指出肠道微生物群在肥胖中起着关键作用。然而,导致肥胖的特定基因和潜在机制仍未明确。本研究从大规模肥胖人群队列中筛选出了潜在致胖菌-巨单胞菌,并揭示了其降解肠道肌醇、促进脂质吸收、导致肥胖发生的机制,为未来的肥胖管理提供了潜在的策略。
1. 通过对631名肥胖受试者和374名正常体重受试者的粪便样本进行宏基因组测序,结果发现肥胖个体的肠道微生物多样性显著降低,且Megamonas(巨单胞菌)属的细菌显著增多。
2. 通过对上述1005名受试者中的814人进行了全基因组测序,并依据多基因分险(PRS)评分量化遗传对肥胖的影响,研究发现,肥胖个体的PRS值显著高于正常体重对照组,表明PRS与肥胖风险呈正相关。
3. 通过比较小鼠的代谢变化,发现接受M. rupellensis补充的HFD小鼠的的脂肪组织重量和脂肪细胞大小均显著增大,且血清中的瘦素、血糖和血清甘油三酯TG水平也呈上升趋势。
4. 利用RNA测序分析发现, M. rupellensis定植小鼠中与脂质消化和吸收相关的基因表达发生了显著变化。进一步通过体外实验发现,M. rupellensis会显著消耗培养基中的肌醇,肌醇补充剂可抑制小肠类器官中脂肪酸的吸收。
参考文献
Wu C, Yang F, Zhong H, et al. Obesity-enriched gut microbe degrades myo-inositol and promotes lipid absorption. Cell Host &Microbe. 2024.
06
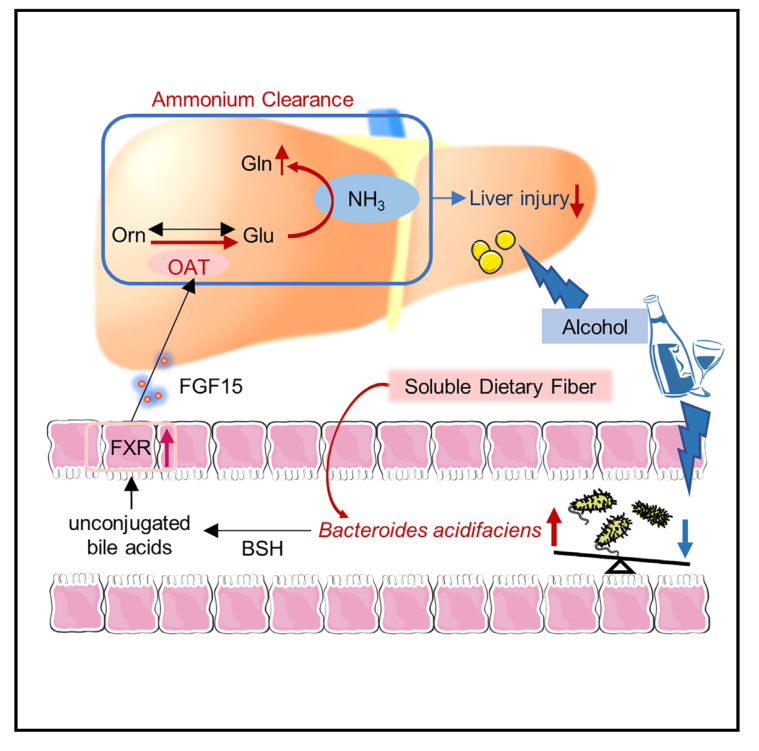
Cell Host & Microbe | 膳食纤维通过酸化拟杆菌和随后的氨解毒减轻酒精性肝损伤
肠道微生物群和饮食引起的微生物组组成变化与各种肝脏疾病有关,但是具体的微生物种类和机制仍未得到充分研究。酒精相关性肝病(ALD)由于其复杂的发病机制,治疗选择有限。本研究发现富含可溶性膳食纤维的饮食,可增加拟杆菌门B.acidifaciens的丰度,并减轻小鼠的酒精性肝损伤,为ALD提供了一种潜在的治疗策略。
1. 通过对小鼠盲肠内容物进行16S扩增子测序,结果发现,添加可溶性膳食纤维的小鼠的细菌组成与酒精喂养的小鼠有显著差异,且酸化拟杆菌(B.acidifaciens)是导致两组差异的关键物种。
2. 通过肝脏组织的蛋白质组学分析发现,补充B.acidifaciens的酒精肝组的鸟氨酸氨基转移酶(OAT,Ornithine Aminotransferase)表达较单纯酒精肝组增加最为明显。
3. 通过肝脏代谢组学,发现 ALD小鼠肝脏中鸟氨酸的积累随着OAT表达的抑制而显著增加。补充B.acidifaciens后,鸟氨酸的积累随着OAT表达的上调而显著降低,肝脏中积累的鸟氨酸代谢为谷氨酸,进入谷氨酰胺合成途径,使得谷氨酰胺水平大幅增加,进而减少因氨积聚引起的肝细胞损伤。
参考文献
Shen H, Zhou L, Zhang H, et al. Dietary fiber alleviates alcoholic liver injury via Bacteroides acidifaciens and subsequent ammonia detoxification. Cell Host & Microbe. 2024.
07
Cell Host & Microbe | Clostridium symbiosum通过产生BCAA来调节宿主胆固醇代谢,从而促进结直肠肿瘤的发生
结直肠癌(Colorectal Cancer, CRC)是全球主要的恶性肿瘤之一,其发生和发展是一个多步骤过程,受包括肠道菌群失调在内的多方面因素的影响。已有研究表明,一种共生梭状芽孢杆菌(Clostridium symbiosum, C. symbiosum)明显在CRC中富集,但其与宿主相互作用促进CRC肿瘤进展的具体机制尚不清楚。本研究发现C. symbiosum通过产生BCAAs、触发胆固醇代谢和下游hedgehog信号传导,调节宿主胆固醇代谢来促进CRC的发生和发展,揭示了C. symbiosum通过支链氨基酸重编程结直肠胆固醇代谢和调节干细胞稳态的潜在代谢贡献。
1. 通过高通量测序,分析CRC患者肿瘤组织和正常组织的C. symbiosum的丰度,发现C. symbiosum在CRC患者的肿瘤组织中选择性富集,并与结直肠腺瘤复发(CRA)的高风险相关联。
2. 通过在多种小鼠模型中引入C. symbiosum,包括CAC模型、ApcMin/+模型和化学诱导的CRC模型,结合体外细胞实验,研究者观察到C. symbiosum促进了结直肠肿瘤的发生和增长。进一步对小鼠结肠进行单细胞转录组分析,观察到C. symbiosum增加了结肠干细胞的比例,并增强了癌症干细胞的特性。
3. 利用代谢组学技术,分析C. symbiosum处理小鼠和无菌小鼠的粪便,发现C. symbiosum通过产生支链氨基酸(BCAAs),增强宿主胆固醇合成,进而激活Sonic hedgehog信号通路,从而促进结直肠癌细胞的增殖和肿瘤干细胞的维持。此外,C. symbiosum激活mTORC1信号通路,增强宿主细胞胆固醇合成,这一过程有助于维持结直肠癌细胞的干性和促进肿瘤生长。
4. 通过药物干预实验,发现降低BCAAs摄入或使用他汀类药物阻断胆固醇合成可以部分抵消C. symbiosum诱导的细胞增殖。
参考文献
Ren, Y.M., Zhuang, Z.Y., Xie, Y.H., et al. BCAA-producing Clostridium symbiosum promotes colorectal tumorigenesis through the modulation of host cholesterol metabolism. Cell Host & Microbe. 2024.
08
Nature | 翻译组重构控制饮食及其对肿瘤发生的影响
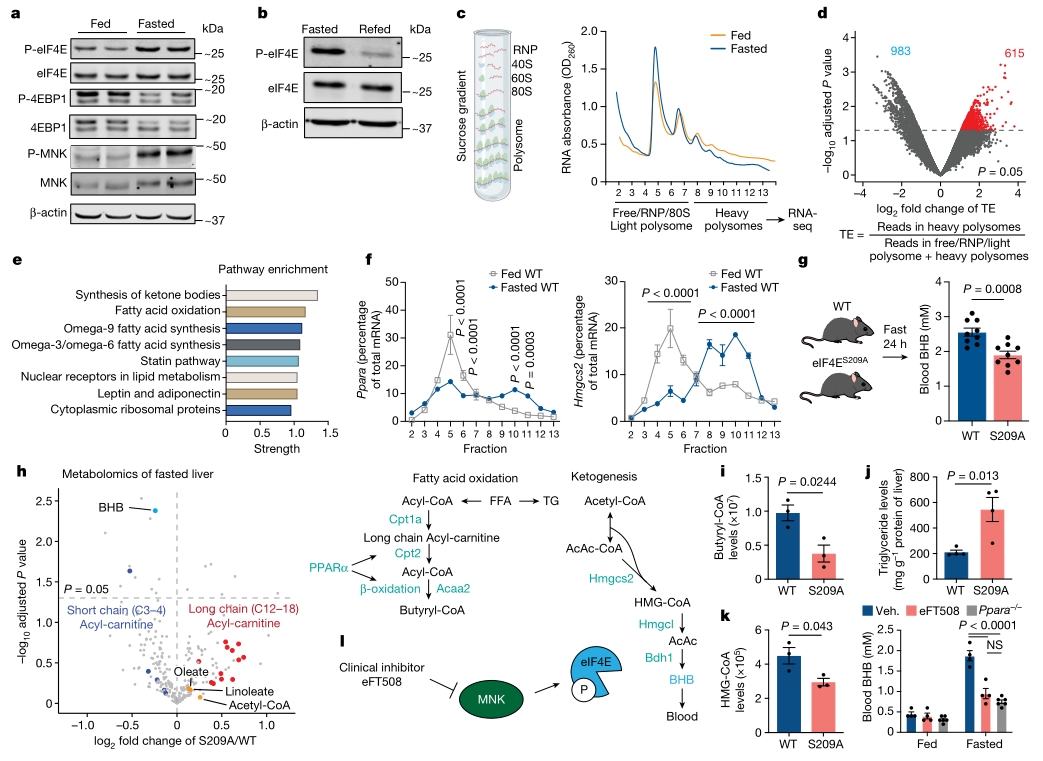
禁食可以带来一系列的健康益处,例如减重、降低炎症等,它会通过代谢重编程,将身体的能量来源从葡萄糖转变成酮体。然而,禁食信号如何引起蛋白质组的变化以建立代谢程序仍然不清晰。本研究探讨了禁食状态下肝脏细胞如何选择性地重塑翻译组(translatome),以及这一过程如何与代谢程序建立并和肿瘤发生相关联,揭示禁食干预肿瘤治疗的新靶点。
1. 使用PolyRibo-seq技术,研究发现在禁食状态下,肝脏细胞选择性地重塑了翻译组,其eIF4E的磷酸化形式(P-eIF4E)显著增加,而整体翻译水平下降。发现禁食24小时后,P-eIF4E的水平显著增加,而eIF4E结合蛋白1(4EBP1)的磷酸化水平下降。
2. 使用代谢组学技术发现在禁食的eIF4ES209A小鼠肝脏中,β-羟基丁酸(BHB)等酮体的生成受到抑制,同时β-氧化的中间产物长链酰基肉碱累积,而短链酰基肉碱减少,表明β-氧化过程出现缺陷。同时发现与脂肪酸代谢和酮体生成密切相关的基因(PPARα和HMGCS2 mRNA)在肝脏中的翻译水平显著增加。
3. 利用小鼠模型发现在生酮饮食下,eFT508(一种P-eIF4E抑制剂)处理显著抑制了胰腺肿瘤的生长,表明P-eIF4E在肿瘤对酮体的利用中起着关键作用。
4. 进一步细胞实验发现脂肪酸如亚油酸(LA)可以直接激活AMPK,进而激活MNK-P-eIF4E轴,从而促进特定mRNA的翻译。
5. 进行体内和体外实验证实在生酮饮食下,抑制P-eIF4E通过减少PPARα的翻译,进而抑制了酮体的生成,为开发针对特定代谢途径的癌症治疗策略提供新的分子靶点。
参考文献
Yang H., Zingaro V.A., Lincoff J. et al. Remodelling of the translatome controls diet and its impact on tumorigenesis. Nature. 2024.
END