温度依赖的hERG通道药理学与动力学特性
简介
hERG (human ether-a go-go-related gene) 基因编码的延迟整流钾通道在哺乳动物和人的心肌细胞动作电位的控制中起着至关重要的作用。多种类型的化学治疗药物存在潜在的hERG 通道阻断风险,可能引起心电图上QT间期的延长。这可能导致严重的致死性室性心律失常——尖端扭转型室性心动过速(torsade de pointes, TdP)。TdP 风险是管理机构和制药公司从市场将药物撤出的主要原因之一(Trudeau, M. C. 1995, Sanguinetti M. C.1995)。
膜片钳技术是体外化合物hERG 抑制效应评价的金标准。尽管在技术层面难度增加,但接近生理温度条件下的膜片钳记录相比于室温条件下更适合于药物安全性评价实验,原因在于温度依赖性进程变化对稳态hERG 通道的抑制有重要影响。已发表数据表明,温度增加能加速hERG 的激活、失活、失活后恢复和去激活的动力学变化,以及稳态水平的抑制(Zhou, Z.1998)。其它研究也证明了一些化合物表现出明显的温度敏感性以及生理温度下显著的效能曲线移动(Sale, H. 2008, Kirsch, G. E, 2004)。因此在生理温度条件下开展功能性hERG筛选是有必要的。相比于传统手动膜片钳,全自动膜片钳系统实现更高的通量、耗费更少的人力资源,在早期功能性hERG 筛选方面开展更多工作。然而,第一代进入市场的全自动膜片钳系统只能进行室温条件下的筛选。
为满足这样的需求,IonFlux 系统配置温度控制模块,使得用户可以运行温度依赖性的电生理筛选。在本片文章中,我们展示了hERG 通道的药理学和动力学特性,比较了IonFlux 平台记录的室温条件与生理温度条件的结果。
材料和方法
监控温度平衡
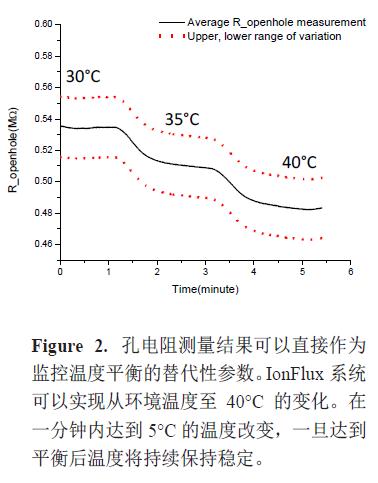
温度改变可以通过细胞添加前孔电阻变化的测量进行监控。缓冲液的电导是温度依赖性的且随着温度的升高而增加。图2 显示了孔电阻测量结果可以直接作为监控温度平衡的替代性参数。IonFlux 系统可以实现从环境温度至40°C 的变化。在一分钟内达到5°C 的温度改变,一旦达到平衡后温度将持续保持稳定。
细胞准备
表达了hERG1a 的中国仓鼠卵巢(CHO)细胞在37°C 和5% CO2 条件下培养在175cm2 顶部过滤的培养瓶中,培养基中含有DMEM、Glutamax-1 (Invitrogen,10565), 10%胎牛血清、和G-418 (500μg/ml)。细胞密度保持在90%以下,实验前转移至30°C 培养箱过夜孵育。细胞收集时,培养瓶先用2ml 的不含钙离子和镁离子的PBS 冲洗,然后加入5ml的Detachin.溶液处理2~5 分钟。在细胞重悬转移至外液中之前,1000rpm 离心90 秒。
溶液和化合物
细胞外液成分(ECS)含有(mM):NaCl 140, KCl 2, MgCl2 3, CaCl2 1, HEPES 10, 葡萄糖9,用NaOH调pH至7.4 。细胞内液成分(ICS)含有(mM):KCl 120, MgCl2 5,CaCl2 10, EGTA 5, Tris-ATP 4,HEPES 10,,用KOH调pH至7.3。重悬在细胞外液中的细胞被加入至IonFlux(每毫升5x106个细胞)记录板。本研究中采用的hERG 电压刺激方案开始于+40mV并持续1秒,随后在–50mV水平下持续1.5秒,每10秒重复一次此方案。细胞钳制在-80mV。峰值尾电流在-50 mV时被记录。
结果
温度依赖 的药理学特性
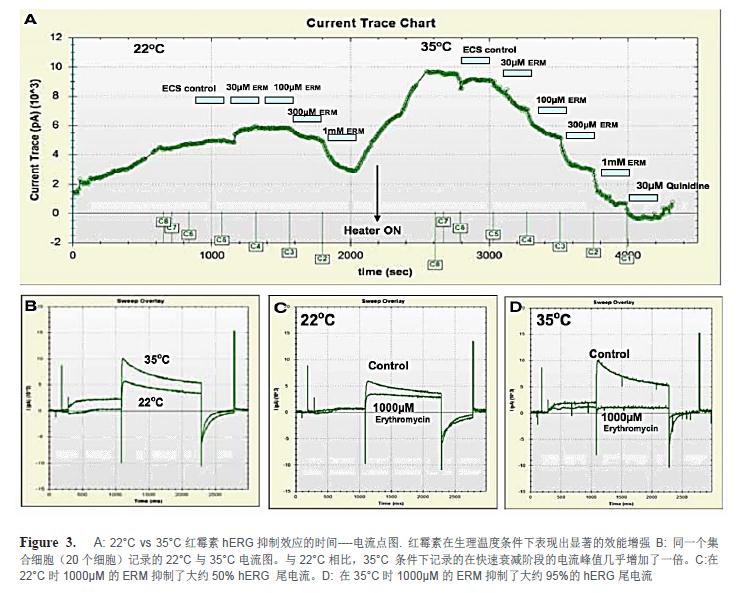
红霉素(ERM)在生理温度条件下具有显著的效能增强特点。图3A显示了室温条件下和生理温度条件下ERM对hERG抑制效应的时间--—电流点图。此实验中细胞在室温(22°C)条件下被捕获和封接,以及记录ERM的阻断。直至添加了300µM ERM 后才观察到显著的抑制效应。此抑制在冲洗后是可逆的。加热功能在冲洗时开启,温度设置在35°C。当温度和电流稳定后,重复添加不同浓度的ERM。使用IonFlux软件中原始电流图重叠功能,使得同一个集合细胞(20个细胞)记录的22°C与35°C电流图共同展现在图3B中。与室温条件相比,35°C 条件下记录的在快速衰减阶段的电流峰值几乎增加了一倍。在22°C时1000µM的ERM抑制了大约50% hERG 尾电流(图3C),而在35°C时同样浓度的ERM抑制了大约95%的hERG尾电流(图3D)此数值与文献报道的结果完全一致(Kirsch, G.E, 2004, Stanat, S, 2003)。
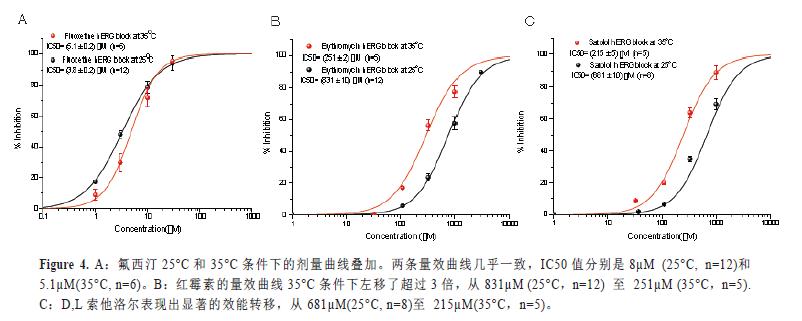
氟西汀是hERG的抑制剂,其不具体有温度依赖的效能改变。在另一个实验中,氟西汀作为对照品与其它两个化合物——红霉素和D,L索他洛尔在同一块记录板中进行检测(IF-HT,384孔)。氟西汀25°C和35°C条件下的剂量曲线叠加显示在图4A中。两个量效曲线大部分重叠在一起,IC50值分别是25°C时的3.8µM和35°C时的5.1µM。相反的,红霉素的量效曲线35°C条件下左移了超过3倍,从831µM(25°C)至251µM (35°C),见图4B。D,L索他洛尔同样表现出显著的效能转移,从681µM(25°C)至215µM(35°C),见图4C。结果表明氟西汀的hERG抑制效应对温度不敏感,而红霉素和索他洛尔是温度敏感的hERG阻断剂。这些结果与文献报道的一些明显温度依赖性化合物的结果一致(Kirsch,G.E,2004,Stanat,S,2003,Rajamani,S,2006,Thomas,D,2002)。
温度依赖的动力学特性
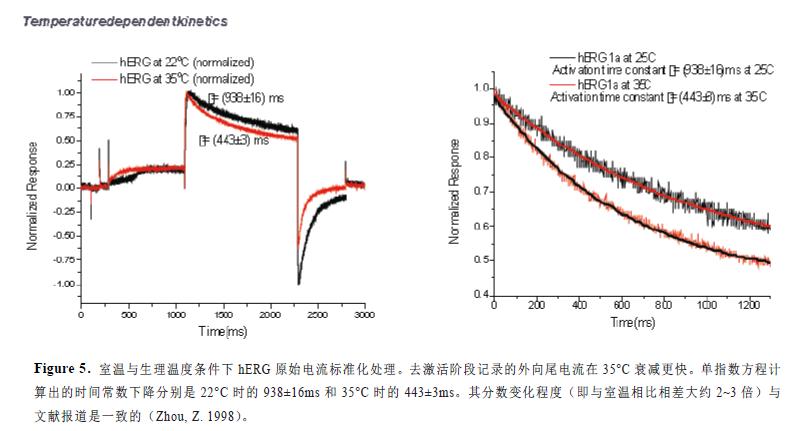
动力学转换的检测提供更多关于温度对离子通道电流影响的信息。我们研究比较了室温和生理温度条件下的hERG 原始电流图(图5)。首先,相比于22°C,35°C 条件下同一个集合细胞记录的电流幅度几乎超过两倍。其次,去激活阶段记录的外向尾电流在35°C 时同样表现出更快的衰减速度。单指数方程计算出的时间常数下降分别是22°C 时的938±16ms 和35°C 时的443±3ms。尽管时间常数的绝对值取决于激活的电压刺激方案,但其分数变化程度(即与室温相比相差大约2~3 倍)与文献报道是一致的(Zhou, Z. 1998)。
讨论
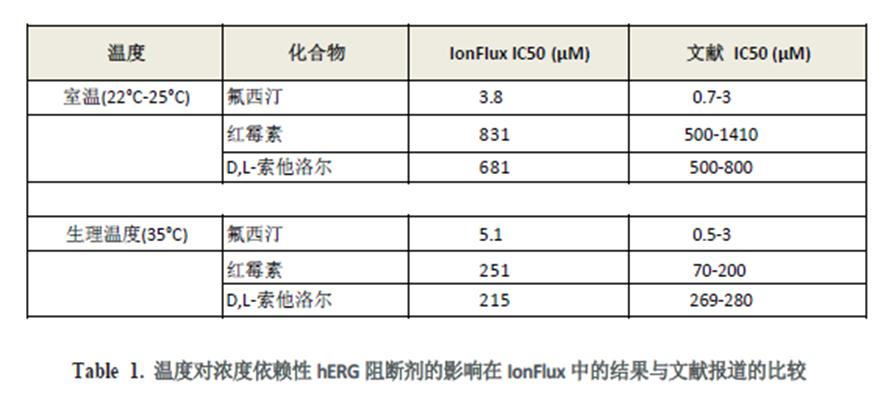
使用 IonFlux 温度控制模块,观察到红霉素与D,L 索他洛尔的抑制效应对温度是敏感的。在近生理温度条件下获得的检测结果IC50 值比室温条件下更低,但对于作为阴性对照的氟西汀,温度变换并没有表现出显著的效应改变。通过IonFlux 平台记录观察到的药理学效应漂移与手动膜片钳数据是一致的(表1)。
动力学研究表明hERG 尾电流峰值在生理温度条件下几乎增加两倍,且去激活引起的外向尾电流的衰减速度加快了2~3 倍,此结果同样与手动膜片钳数据是一致的。生理温度条件下的hERG 筛选产生的数据可以与在体的心脏安全评价数据提供更好的相关性。因而,在药物安全性评价实验中温度是一个值得关注的因素。IonFlux 系统独到的设计可以提供温度控制模块,便于开展温度可能最为重要因素的hERG 安全性筛选和其它温度依赖的离子通道靶标。
参考文献:
Trudeau, M.C & Robertson G.A. (1995) Science 269, 92-95
Sanguinetti MC et al. (1995). Cell 81:299-307
Zhou Z, et al. (1998) Biophys J 74:230-41
Sale, H. & Robertson G. A. (2008) Circ. Res. 108 185249
Kirsch, G. E. (2004) J . Pharm. & Tox. Methods 50, 93-101
Stanat, S. (2003) Molecular &. Cellular Biochem. 254, 1-7
Rajamani, S.(2006) British J. of Pharm. 149, 481-489
Thomas, D.(2002) J. of Pharm. &Exp. Therapeutics 300, 543-548