
期刊:Nat Commun
影响因子:14.7
主要技术:mRNA-seq、华大C4
导语
干扰素(IFN)治疗慢性乙型肝炎病毒(HBV)的潜在机制,特别是在低HBsAg和/或年轻患者中,由于缺乏替代治疗方法,目前仍未得到解决。通过CRISPR/ cas9敲入策略,研究了干扰素受体人源化小鼠(huIFNAR小鼠)的基因表达。证明了人类IFN刺激huIFNAR的PBMCs中的基因表达谱与人类PBMCs中的基因表达谱相似,支持了该小鼠模型在体内功能分析人类IFN的代表性。揭示了响应人类IFN治疗的多器官组织特异性基因表达图谱;这种模式尚未在健康人体中报道。最后,通过AAV-HBV模型测试人干扰素的抗病毒作用。PEG-IFNα2治疗15周可显著降低HBsAg和HBeAg,甚至实现HBsAg血清转化。人干扰素对CD8T细胞的激活可能是抑制HBsAg的关键。huIFNAR小鼠能够真实地响应人干扰素刺激,为研究干扰素在体内的功能提供了平台。PEG-IFNα2治疗成功抑制肝内HBV复制,并实现HBsAg血清转化。
技术服务
mRNA-seq、华大C4
研究结果
1. 人源I型干扰素受体小鼠模型的建立
为了研究人类IFN在小鼠中的作用,设计了一个由人类IFNAR2和IFNAR1组成的串联表达盒,它们由一个2A序列连接,并将其置于小鼠IFNAR2启动子的控制下表达。这两种小鼠IFNAR1和IFNAR2基因的距离分别位于16号染色体上(仅130kb),避免了连续两轮的基因操作,节省了时间。对于小鼠Ifnar2基因,在ATG起始密码子旁边的第2外显子中插入一个外源序列,不仅使启动子活性不受干扰,而且在第1外显子和第2外显子之间保留了一个完整的内含子,增加了新mRNA的稳定性。在3‘端有一个polyA信号序列,提供了一个转录停止信号,并导致小鼠IFNAR2的表达中止。这个设计保持了插入的人IFNAR1和IFNAR2基因的表达,同时导致小鼠IFNAR缺陷
在嵌合的huIFNAR中,既可以对人的IFNα刺激作出反应,又可以保证结合蛋白的募集和下游通路的激活。通过逆转录PCR证实了huIFNAR mRNA的表达。流式检测细胞表面huIFNAR2蛋白的正常表达。最后,在体内和体外测试huIFNAR小鼠是否对人I型干扰素注射有反应。人IFNα2处理导致小鼠Mx1(mMx1)和小鼠Isg15(mIsg15)mRNA水平上调。然而,当huIFNAR被抗hR1和/或抗hR2抗体阻断时,这种激活作用减弱,这意味着huIFNα2诱导的mMx1和mIsg15表达的增加是由人源化的I型IFN受体介导的。为检测huIFNAR小鼠在体内的反应,腹腔注射人PEG-IFNα2。在huIFNAR小鼠的PBMCs、肝脏和脾脏中观察到mMx1和mIsg15 mRNA水平显著升高,进一步证实了huIFNAR小鼠已成功构建,并对人干扰素刺激有反应。通过WB检测脾脏组织中mISG15的表达。与小鼠IFNα5相比,人PEG-IFNα2诱导的mISG15蛋白水平显著升高。综上,作者成功地生成了功能性I型干扰素受体人源化小鼠。
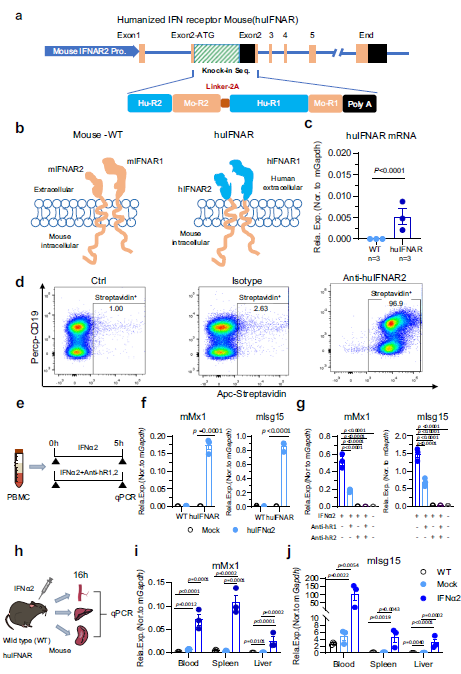
Fig 1. I型干扰素受体人源化(huIFNAR)小鼠的产生和功能评价
2. Peg-IFNα2刺激huIFNAR小鼠PBMCs中的免疫反应与人类PBMCs中类似
使用mRNA测序比较了小鼠PBMCs和人类PBMCs中受刺激的基因表达谱。与模拟处理相比,487个ISG中有199个有显著变化。利用每个huIFNAR PBMCs和人类PBMCs的前5000个DEGs进行KEGG富集分析。PEG-IFNα刺激了huIFNAR PBMCs中109条KEGG通路富集和人PBMCs中146 最显著富集的BP非常相似。与免疫系统过程和代谢相关的变化进一步证实了这种相似性。人Peg-IFNα2诱导的huIFNAR小鼠与人PBMCs的基因反应高度相似,表明huIFNAR小鼠可以作为探索人I型干扰素在体内功能的替代模型。
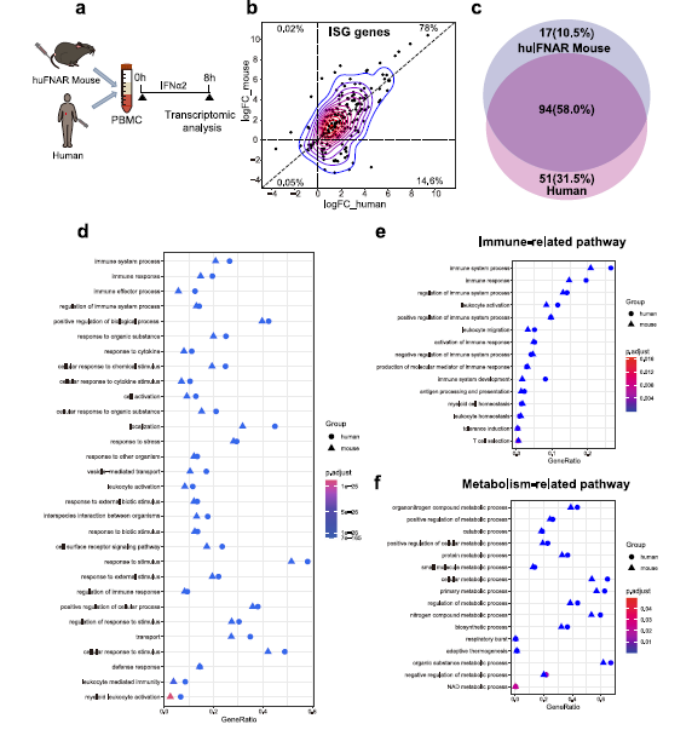
Fig 2. 小鼠huIFNAR与人PBMCs对人IFN刺激反应的相似性分析
3. 人类IFNα2的组织特异性应答图谱
选择了9个主要组织(脑、血、肺、心、肝、脾、肾、肌肉和肠)来消除体内对人PEGIFNα2刺激的组织特异性反应。在不同的组织间观察到huIFNAR mRNA水平的不同。血液、肝脏和脾脏的huIFNAR表达水平最高,肌肉、肠道和大脑的表达水平最低。因此,不同组织对IFNα2的反应有很大差别。血液、肝脏和脾脏在PEGIFNα2刺激下表现出最明显的图谱变化。心脏、大脑和肠道的反应较微弱。分级聚类显示,与血液相比,肝脏中的一个小基因簇显著上调。与肝脏相比,血液中的另一个基因簇下调。对前50个ISG的变化进行了分析,发现组织之间在数量和大小上存在显著差异,突出表明每个组织对干扰素都有独特的敏感性。在体内全面的组织特异性基因表达图谱揭示了对人类IFNα2刺激反应的功能差异性。
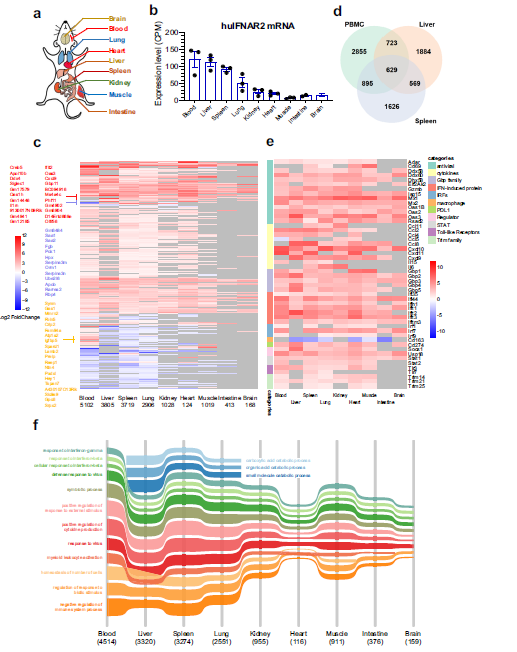
Fig 3. 响应人PEGIFNα2的组织特异性转录组图谱
4. 人Peg-IFNα2治疗降低了HuIFNAR小鼠中的HBsAg水平
选择了一个包含1.3倍HBV基因组(AAV-1.3XHBV)的腺相关病毒载体,以保证HBV在小鼠中长期存在。在PEG-IFNα2治疗前6周,通过尾静脉注射AAV-1.3×HBV。野生型C57BL/6J作为PEG-IFNα2治疗对照。每周检测病毒HBsAg、HBeAg和HBV DNA。与野生型小鼠相比,HBV生物标志物如HBsAg和HBeAg在早期时间点存在差异。与预期的一样,PEG-IFNα2在C57BL/6J小鼠中未能抑制HBV。相比之下,IFNα治疗组的HBsAg从第7周开始开始下降。从第10周到终止治疗,当每周使用两次PEG-IFNα2时,并没有观察到进一步的下降。在终止时,PEG-IFNα2中的平均血清HBsAg水平约为模拟小鼠的8.04倍。同样,HBeAg从第9周开始下降,但在终止时仅下降了2.15倍。一只经PEG-IFNα2处理的huIFNAR小鼠获得了HBsAg和HBeAg的丢失,而另一只经处理的huIFNAR小鼠在接受PEG-IFNα2治疗后,HBsAg显著减少。在PEG-IFNα2组的6只小鼠中有2只中检测到HBsAb。PEG-IFNα2降低肝内病毒pgRNA和总mRNA,在#3小鼠中几乎完全抑制。肝内病毒rcDNA结果显示,huIFNAR模型中的HBV rcDNA水平比野生型C57BL/6J AAV-HBV模型低一半。
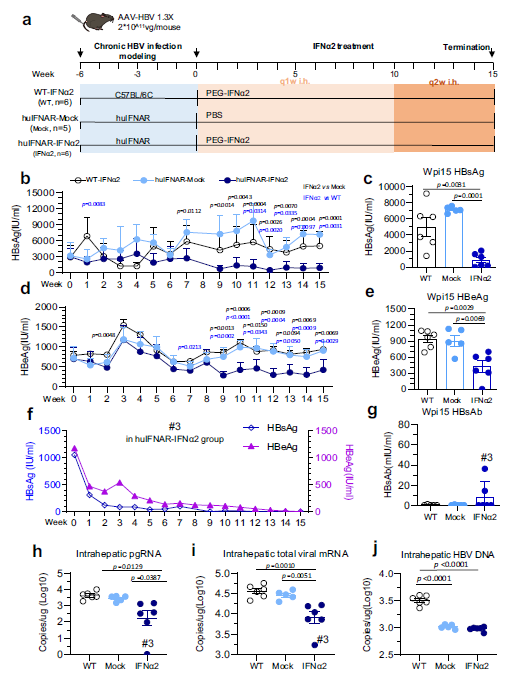
Fig 4. 人PEG-IFNα2在huIFNAR AAV-HBV小鼠模型中抑制HBV
5. PEG-IFNα2治疗15周后肝内免疫细胞群的改变
对8856个细胞的基因表达数据进行聚类分析,揭示了8个主要不同的细胞类型。PEG-IFNα2治疗显示出增加髓系和中性粒细胞数量的趋势,并减少NK/T和B细胞数量。与模拟小鼠相比,在peg-IFNα2处理的小鼠的单核细胞中,有67个基因表达上调,16个基因表达下调。这些差异表达的基因富集于NF-kappaB信号通路、toll样受体信号通路、细胞凋亡和IL-17信号通路。单核细胞似乎具有促炎的特性。与模拟治疗相比,IFNα2使单核细胞敏感,使其对IFN更敏感,增强抗原呈递,提高共刺激分子表达,对免疫细胞更有吸引力,以及增殖活性。utg1a高的簇更容易对IFN产生反应,而MHCI高的簇显示出更高的抗原呈递评分。trem1高的簇似乎对IFN的反应较弱,趋化因子促炎症和增殖的得分较高。流式分析显示,经PEG-IFNα2治疗后,肝脏中MHCII+ Ly6C+单核细胞和促炎巨噬细胞显著增加。
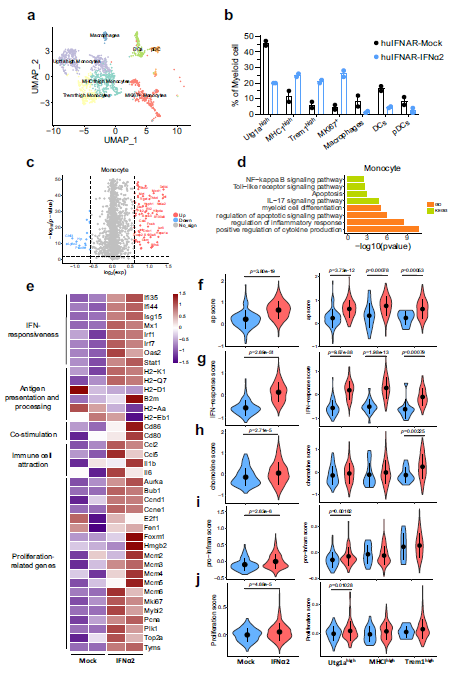
Fig 5. 单细胞水平干扰素治疗15周后肝内单核细胞的特征
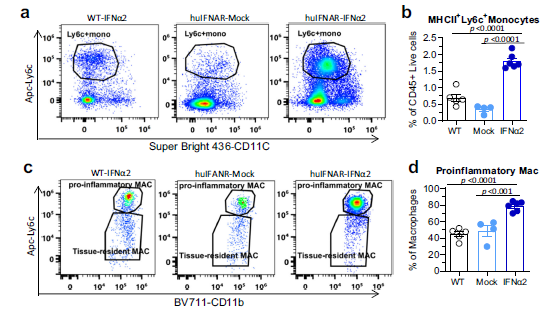
Fig 6. 肝内单核细胞和巨噬细胞的流式分析
与模拟小鼠相比,NK和NKT细胞在PEG-IFNα2处理的小鼠中的数量略有减少,但肝脏常驻NK细胞的数量显著减少。T细胞在肝脏中富集,但CD4水平不受影响。PEGIFNα2处理组的CD8+ T细胞显示出白细胞粘附、激活和T细胞受体信号传导等功能上调。整个CD8+细胞在活化、趋化因子、细胞毒性和衰竭方面的得分较高。Lef1+CD8t细胞数量明显减少,而TeffCD8t细胞数量明显激。肝内Teff CD8 T细胞表现出活化功能、细胞毒性功能和趋化性功能的增强。Teff CD8 T细胞也失调了耗尽特异性基因的表达,并表现出耗尽的基因表达谱,表明这些细胞群的效应功能包括衰竭分子的上调。流式分析还显示,效应记忆CD8+ T(TEM)细胞显著增加,CD8+ TEM和总CD8 T细胞均表达PD-1水平升高。使用酶联免疫吸附点(ELISpot)试验分析了HBV特异性T细胞的免疫反应。用HBV和HBsAg刺激肝内淋巴细胞。测定分泌的小鼠IFN-γ。但没有观察到HBV特异性T细胞。总之,在效应CD8T细胞中,衰竭生物标志物的共同表达可能会降低这些细胞在体内抑制HBV的效力。
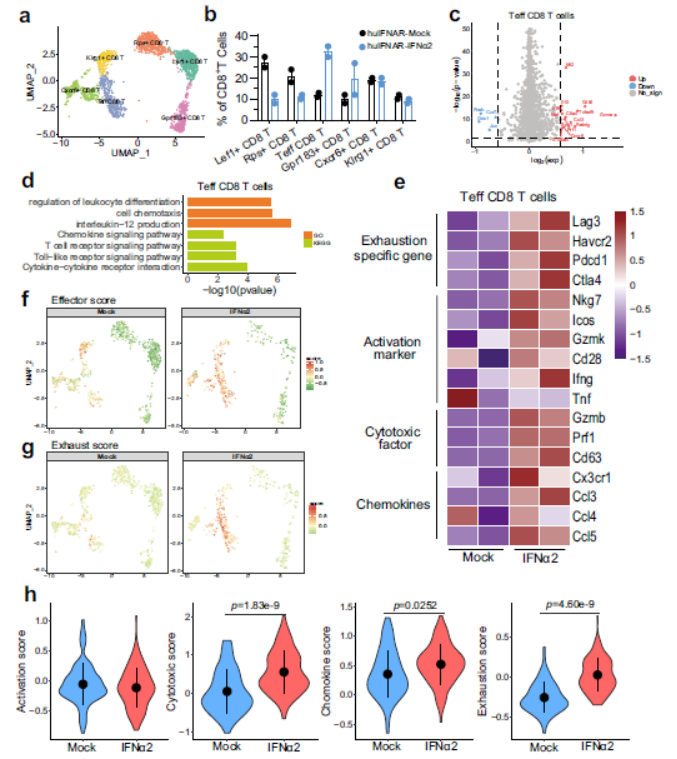
Fig 7. 单细胞水平干扰素治疗15周后肝内CD8+ T细胞的特征
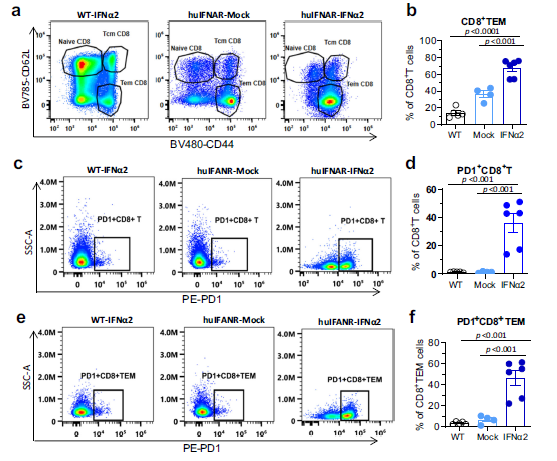
Fig 8. 肝内CD8+ T细胞的流式分析
参考文献:
Wang Y, Guo L, Shi J, Li J, Wen Y, Gu G, Cui J, Feng C, Jiang M, Fan Q, Tang J, Chen S, Zhang J, Zheng X, Pan M, Li X, Sun Y, Zhang Z, Li X, Hu F, Zhang L, Tang X, Li F. Interferon stimulated immune profile changes in a humanized mouse model of HBV infection. Nat Commun. 2023 Nov 15;14(1):7393. doi: 10.1038/s41467-023-43078-5IF: 14.7 Q1 . PMID: 37968364; PMCID: PMC10652013.
