免疫组织化学(IHC)是检测生物标记物表达的最简单方法之一,它可以原位检测组织或细胞的标志物。但在真正操作过程中,问题还是层出不穷。当你的IHC结果不理想时,就要静下来,逐步分析找其原因。除了抗体和试剂很重要之外,各实验操作细节的好坏,也是影响IHC染色结果的重要因素。
本文着重介绍,如何进行抗原修复(Antigen Retrieval)?
温馨提示:您可以选择观看视频,或直接阅读文字,两种方式花费时长均约3分钟。

点击上图观看视频
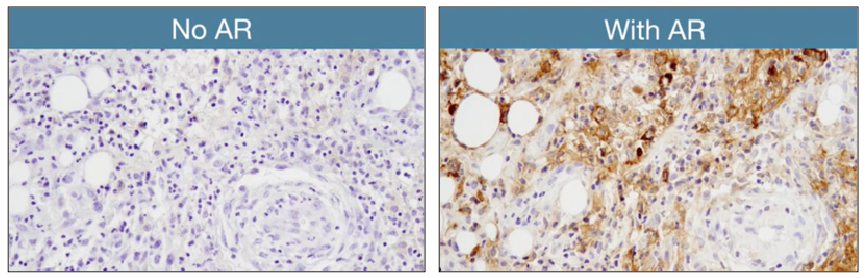
抗原修复是影响IHC染色强度的因素之一,通过加热样本或用酶处理样本便可完成抗原修复。在这个视频中,我们将重点关注热诱导的表位修复,或简称为HIER。在对样本进行脱蜡以及在添加抗体来检测靶蛋白之前,进行抗原修复。抗原修复会去除因醛基固定而形成的交联,并解旋蛋白的二级和三级结构,使抗体能够检测表位。对于深埋在蛋白结构中的表位,这一点尤其重要。
PD-L1 (E1L3N®️) XP®️ # 13684
在你的标准HIER实验步骤中,将样本浸入缓冲液中,并煮沸一段时间,通常为10-20分钟。常用加热方法包括水浴、微波炉或高压锅。这些方法的修复程度各不相同,水浴效果最差,高压锅效果最好。CST的IHC实验步骤建议使用微波炉,它对抗原修复是有效的,并且你的实验室中很可能就有这个设备。
PD-L1 (E1L3N®️) XP®️ # 13684
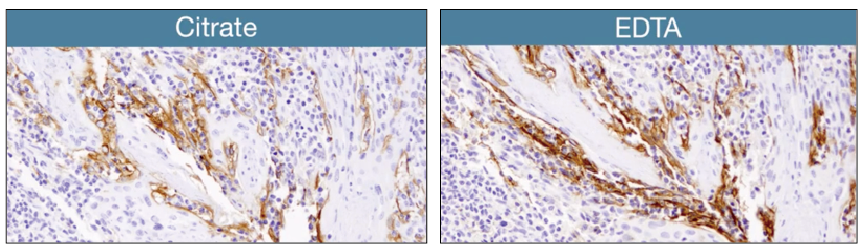
配置1x柠檬酸盐缓冲液,或EDTA,向您的容器装入250mL这种缓冲液。用空白玻片填满玻片夹的所有空槽。这将确保各个实验之间缓冲液和热分布一致。将盖子稍微留一条缝隙,释放压力,因为这可确保缓冲液不会沸溢并露出玻片顶部。此外,过度加热玻片会导致缓冲液流失,从而使组织变干燥。这可能会产生假阴性结果。抗原修复中的一个常见错误操作是沸腾过度,这会导致组织从玻片上脱落。为了优化微波炉加热时间和功率,我们建议进行预实验。将24个空白玻片放入250ml缓冲液中,并确定达到起初沸腾时间。接下来,确定维持亚沸温度8-10分钟所需的功率级别。确定微波炉的条件后,每次都以相同的方式进行修复,始终使用等量的缓冲液,并用空白玻片填满空槽。
你可以在cellsignal.cn的产品页面上找到各抗体的特定应用的完整实验步骤。如果您对某种抗体或实验步骤有任何疑问,您联系我们全国免费技术热线4006-473287(GreatQ),或邮箱tech@cst-c.com.cn。祝您实验成功!
相关产品推荐
