ClonePix技术快速筛选和开发高表达GPCR的哺乳细胞系

ClonePixTM 2系统提供了一种全新、快速评估哺乳细胞系GPCR靶蛋白表达水平的方法
l 用哺乳表达系统快速评估GPCR靶蛋白的內源表达水平
l 增加发现最优细胞反应器的可能性
l 减少细胞系/抗体开发的时间—避免有限稀释法
背景
关于细胞系的开发,从转染细胞库中发现和筛选高表达GPCR克隆是非常有挑战的。ClonePix技术是已被证明的,一步法快速筛选大量异源细胞(3周10,000个克隆)。由于极其大容量的细胞库能够被筛选,大大增加了发现最优细胞生产器的可能性。利用白光和荧光的原位成像技术,ClonePix 2系统具有足够的灵敏性能够检测细胞表面有限表达的内源性蛋白。
方法
材料
l 细胞系:CHO-M1细胞系,表达内源G蛋白偶联毒草碱1胆碱受体(ATCC,M1 WT3-CRL1985). 亲本CHO-K1细胞用作阴性对照。
l 抗体:兔抗ChRM1-PE标记,多抗(Bioss,Cat.#ABIN668656); 兔抗-CHRM1 多抗,无标记;(Bioss,Cat.#bs-1150R); 山羊抗兔IgG-PE标记,多抗(Life Technologies, Cat.#P2771MP)。
l 培养基:Ham’s F12培养基(Corning cellgro, Cat.#10-080-CV);CloneMedia-CHO-S (Molecular Devices,Cat. #K8710); Fetal Bovine Serum (Hyclone, Cat.#SH30071.03), 1% Pen/Strep/Glutamine (Life Technologies,Cat. #10378016), 450 μg/mL Geneticin, G418 (LifeTechnologies, Cat. #10131035)。
l 反应缓冲液:10X HBSS (Life Technologies, Cat.#14065056) 无菌水稀释,注射用。(Irvine Scientific, Cat. #9309),20 mM HEPES (Life Technologies, Cat. #15630080). pH 调整到7.4。
l FLIPR® Calcium 6 Assay Kits (Molecular Devices, Cat.#R8190)。
l 微孔板: 6-well non-TC treated, clear-bottom plates (Greiner Bio-One, Cat. #657185); 384-well black-wall, sterile,TC-treated, clear-bottom plates (Corning, Cat. #3072)。
l M1 AChR agonist: Carbamoylcholine chloride or Carbachol(Sigma, Cat. #C4382)。
仪器概述
ClonePix 2 系统
l 筛选和挑取哺乳细胞克隆的自动化系统
l 白光和荧光成像
l 透射光支持低对比度克隆如单层贴壁细胞成像
l 软件控制5对激发/发射滤光片的切换
l 用户自定义标准进行克隆排序
l 目标克隆识别和挑取到96孔目标板
l 支持悬浮和贴壁细胞的多种应用
l 筛选和挑取分泌抗原特异性抗体的杂交瘤细胞
l 细胞系开发
CloneSelect Imager
l 无标记的白光细胞成像技术
l 客观、定量评价细胞生长
l 简单、容易使用的软件界面
l 准确获取96孔板每个孔细胞的生长率
l 支持多种应用:
l 监控细胞生长
l 单克隆验证
FLIPR Tetra 系统
l 标准EMCCD荧光检测或可选ICCD荧光和化学发光检测
l 用户可配置96-、384-、和1536孔板
l 用户可更换的悬浮细胞选项
l 独特的,可配置激发光学拓展了荧光种类的应用
l 直观、容易使用的软件界面
l TetraCycler内置的抓板器可增加系统的通量
半固体培养基培养细胞
直接标记的方法:PE标记的CHRM1抗体随细胞直接加到半固体培养基中。对照孔包括细胞但是没有抗体。
双抗体方法:直接标记的方法没有效果的时候,用一抗和二抗测试可行性。非标记的rabbit anti-muscarinic抗体和PE标记的抗兔多克隆二抗随细胞直接加到半固体培养基中。对照孔包含细胞但没有抗体,连同仅仅含有二抗的对照孔。
ClonePix2系统成像和挑取表达GPCR(M1)的细胞克隆
无论是直接标记方法还是双抗体方法,根据ClonePix2的记录,CHO-M1阳性细胞产生大范围的荧光信号。图1显示了M1 GPCR不同程度的表达。正如预期,亲本CHO-K1细胞没有产生荧光信号。
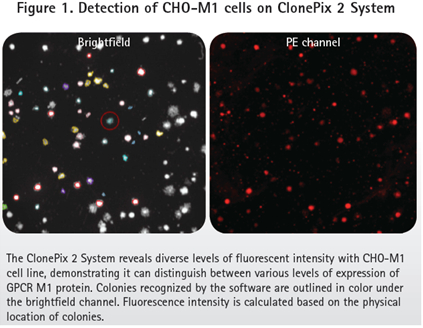
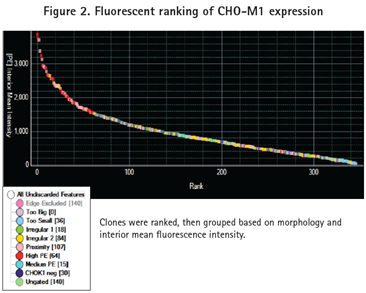
细胞基于形态和荧光强度被分组。挑取克隆的形态基于大小、形状和克隆之间的邻近度。形态学理想的克隆根据内部荧光强度排名,并设门分为四个荧光组:高、中、CHO-K1阴性和ungated(图2). CHO-K1阴性组被定义为背景荧光信号。所有的克隆识别对应于阴性对照孔。Ungated克隆是指低荧光信号但高于背景荧光信号的克隆。
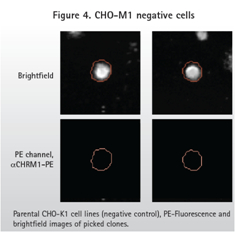
直接标记抗体和双抗体的方法(图3)显示了阳性样品(表达M1)的荧光信号和无荧光信号的亲本细胞系(图4)。正如预期,由于一抗和二抗结合,双抗体的方法在PE通道产生了更高的背景信号。然而ClonePix2在明场检测细胞,然后再看细胞克隆内的荧光信号。在PE通道中识别到但在明场识别不到的物体不被当做是克隆。因此,ClonePix2系统好处是具有从背景信号中区分真实克隆的能力。
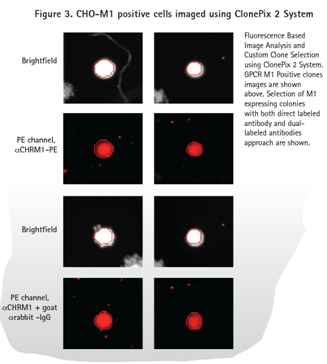
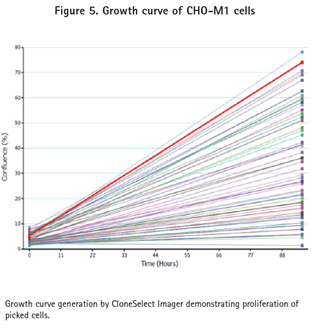
ClonePix2系统挑取的克隆CHO-M1储存到含200μL Ham’s F12 media+10%FBS+G418的96孔Greiner板,而CHO-K1克隆储存到同样的微孔板但不包括G418。这些96孔板在CloneSelect Imager系统中成像确认细胞的转移和生长(图5)。细胞培养一周后再使用CloneSelect Imager分析确保细胞已经增殖(图5和6)。细胞随后转移到384孔板,用FLIPR Tetra系统和钙6试剂进行功能确认。

FLIPR Tetra系统验证ClonePix2挑取细胞的M1 GPCR表达
细胞准备
加入钙敏感荧光染料
FLIPR Tetra 荧光成像读板仪
曝光(sec) 0.53
激发LED(nm) 470-495
发射滤光片(nm) 515-575
LED 强度(%) 80%
FLIPR 钙6 试剂盒
FLIPR Calcium 6试剂盒验证挑好的CHO-M1和CHO-K1细胞克隆
受配体GPCR的激活,受体构象的改变触发胞内G蛋白的激活。活化的G蛋白具有诱导胞内的不同信使包括钙信使的潜能。
ClonePix2系统挑取的不同组细胞用FLIPR Tetra系统来评价功能活性。在40nM的Carbachol条件下,钙敏感荧光染料(FLIPR Calcium 6 Assays kit, Molecular Devices)用来评估胞浆中钙离子随着激活的G蛋白偶联IP3敏感通路的变化而变化的可行性研究。历史数据表明,40nM Carbachol 是 EC80的浓度。
在高荧光的CHO-M1细胞克隆中,相对背景,Carbachol产生了增加4倍的荧光读数(图7A)。在混合中和低荧光的CHO-M1细胞克隆中,Carbachol分别产生了4倍到2倍的荧光读数增加(图7B)。最后阴性对照的CHO-K1细胞,Carbachol没有引起荧光读数的任何变化(图7C)。由于每组细胞,除了中和低表达荧光的混合细胞,是分别种在不同的384孔板中,在加入40nM的Carbachol之前,每孔基线荧光强度的变化都进行了背景荧光的均一化。

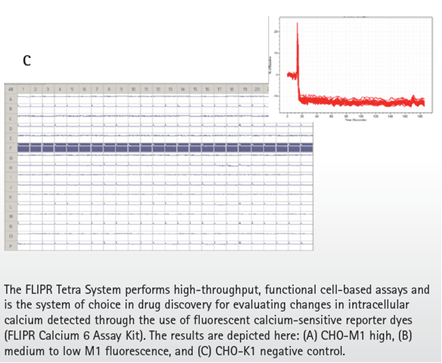
这些结果支持了在膜结合G蛋白偶联毒草碱受体表达水平和功能活性之间的正相关性。缺乏荧光信号的CHO-K1细胞阴性对照进一步确认了ClonePix2系统能准确区分表面表达M1 GPCR 的细胞和表面没有表达M1 GPCR的细胞。
总结
ClonePix2系统能够有效用于检测和挑取不同GPCR表达水平的细胞克隆,因此为需要高质量GPCR蛋白的各种应用提供了唯一的资源,这些应用包括(1)使用高表达天然表位的抗原生产相应的抗体;(2)表达GPCRs困难的特殊GPCR家族的细胞功能分析。
