导语:
看过无数篇凋亡小体相关的文献,倏然看到炎症小体,是不是有些不适应?炎症小体的研究目前只有短短十几年,但在近几年已经成为了研究热门趋势之一。如果你对细胞炎症、细胞程序性死亡领域感兴趣,炎症小体是你不得不了解的关键词。

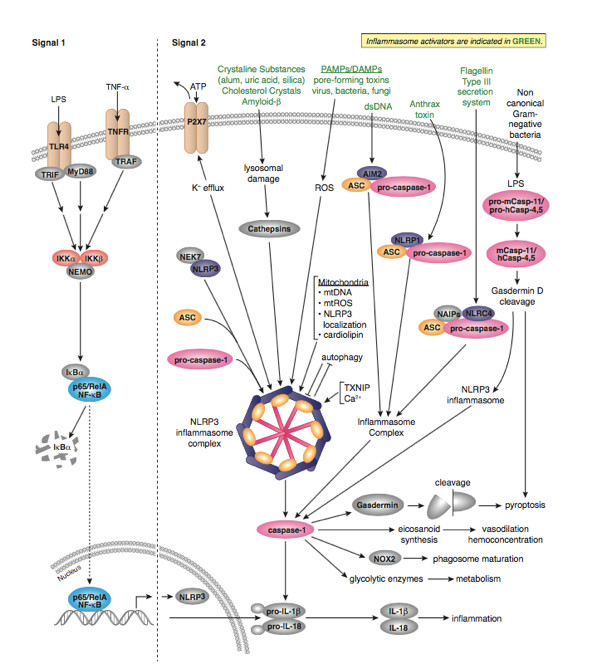
作为炎症反应的重要组成部分,炎症小体在 2002 年被发现以后就一直是免疫和炎症疾病领域的重点研究对象。炎症小体(Inflammasome)是由胞浆内模式识别受体 (PRRs) 参与组装的多蛋白复合物,主要包含受体蛋白(即 PRRs)、接头蛋白 ASC(也称为 TMS1)以及下游的 Caspase-1。受体蛋白被激动剂激活后,会随之吸引 ASC 和 caspase-1 组装成直径可达微米级的炎症小体,从而诱导 caspase-1 自切割并活化。活性 caspase-1 一方面促进包括白细胞介素-1β(IL-1β)和-18(IL-18)在内的多种促炎性细胞因子的成熟和分泌,另一方面引发一种程序性炎性细胞死亡,即细胞焦亡(Pyroptosis)(图 1)。
炎症小体的受体蛋白包括 NOD 样受体 (NLR) 家族成员(如 NLRP1, NLRP3,NLRC4 等)以及来自 HIN200 家族的 AIM2。NLR 家族成员是构成炎症小体的一大类受体蛋白,它们大多数含有 LRR(Leucine-rich Repeat)结构域,可以识别细胞内一系列的「危险」信号。
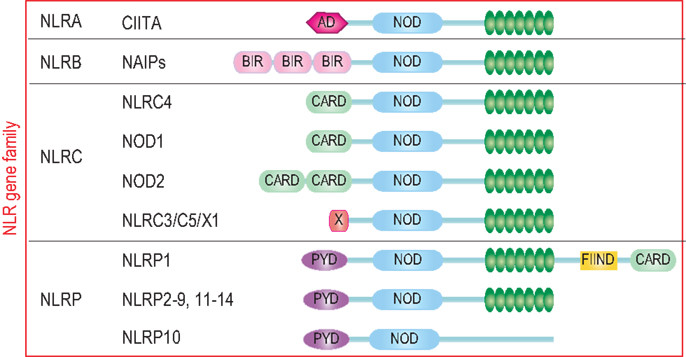
图 2:NLR 家族成员结构示意图【1】
大部分炎症小体只会被一种或少数几种高度特异的激动剂激活,但 NLRP3 是一个例外,它能够对数量繁多并且在来源、化学组成、结构性质上都毫无关联的激动剂做出反应,因此它的功能范围也是所有炎症小体中最为广泛的,是大家研究最多也最深入的一个代表。NLRP3 激动剂不仅包括来自入侵病原体的病原相关分子模式(pathogen-associated molecular patterns,PAMPs)(例如细菌 RNA、细菌多肽类抗生素和流感病毒离子通道蛋白),还有受损机体自身产生的损伤相关分子模式(damage-associated molecular patterns,DAMPs)(例如 ATP),以及多种跟疾病密切关联的分子(例如阿尔茨海默病中的β-淀粉样蛋白(amyloid β)以及动脉粥样硬化中的胆固醇结晶(cholesterol crystal))等等。因此,NLRP3 炎症小体在病原体感染、自身炎症反应、神经退行性疾病、癌症、2 型糖尿病等多种人类疾病中都发挥着举足轻重的作用【2-7】。
NLRC4 炎症小体特殊之处在于不含 PYD 结构域而含有 CARD 结构域,也就意味着其不需要 ASC 蛋白作为「桥梁」而可以直接通过 CARD:CARD 相互作用和效应蛋白连接。对细菌鞭毛蛋白和细菌保守的 type II 型分泌系统 (TTSS) 的组分作出的应答,NLRC4 (IPAF) 炎性体形成【8-12】。配体检测和配体依赖型 NLRC4 寡聚化和炎性体激活需要【13,14】蛋白 NAIP 家族。在小鼠中,NAIP5 和 NAIP6 与鞭毛蛋白有关,而 NAIP2 与 TTSS 杆蛋白发生相互作用【13,14】。NAIP 可识别人体内的 TTSS 针蛋白 Cprl【14】。另外,PKCδ 对细菌感染作出应答使 NLRC4 磷酸化,而合一磷酸化对炎性体组装和 caspase-1 激活 是必要的【15】。
而 AIM2 则是一类 DNA 感受器,可以通过它 C 端 HIN200 结构域识别并结合自体或异体的 DNA,这一过程是不依赖序列就能完成的。而 IFI16 炎症小体被认为可以在细胞核内识别一些病毒如 KSHV 的 DNA,其结构和 AIM2 类似,都需要 ASC 作为「桥梁」发挥连接作用【16-18】。
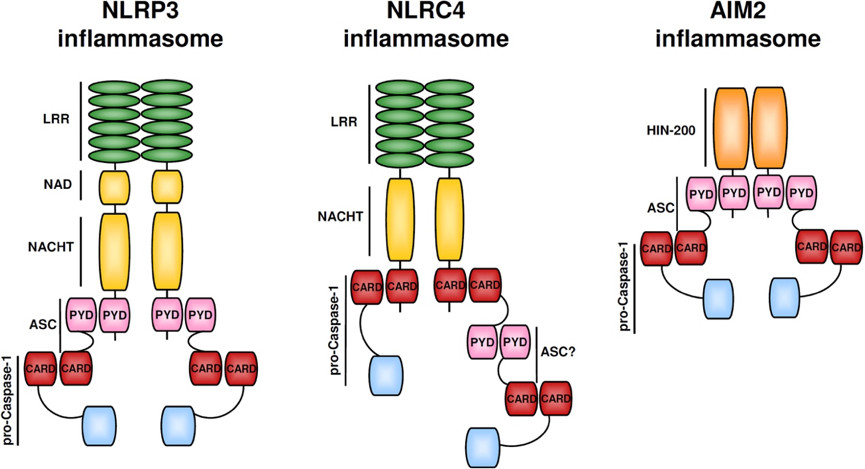
图 3 几种常见炎症小体的结构组成示意图
另外,炎症小体的组装离不开早期炎症信号诱导的受体蛋白(如 NLR 家族成员,AIM2 等)、接头蛋白 ASC/TMS1、pro-IL-1β 和 pro-IL-18 等分子的表达增强,因此,大家常常会通过 WB 来检测这些分子的表达变化。
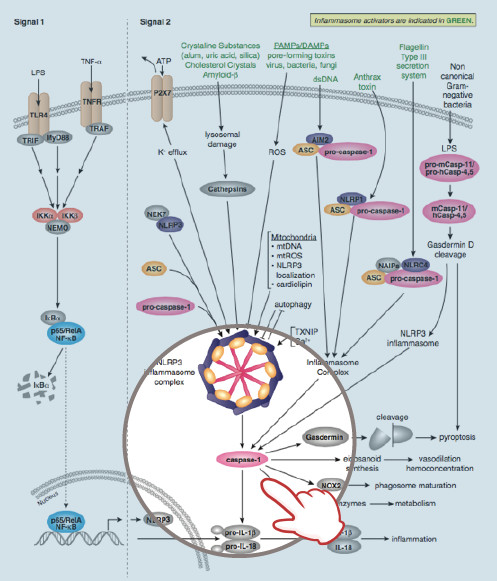
Caspase-1 又被称为白介素-1ß 转化酶 (ICE/ICEα) ,是一种 I 类半胱氨酸蛋白酶。与 Caspase-1 功能接近的 Caspase 还包括 caspase-4、-5、-11 和 -12,它们一起构成 Caspase-1 亚家族。Caspase-1 能够将炎症细胞因子(如 pro-IL-1ß 和干扰素-γ 诱导因子 (IL-18))裂解成成熟蛋白【19,20】。与其他半胱天冬酶一样,caspase-1 通过酶原蛋白水解被激活,产生一个由两个活性亚基(p20 和 p10)组成的四聚体。Caspase-1 具有巨大的氨基末端前体域,此区域包含一个半胱天冬酶募集区域 (CARD)。Caspase-1 过表达会诱导细胞凋亡【21】。Caspase-1 缺失小鼠在凋亡方面没有严重缺陷,但在 pro-IL-1β 蛋白的成熟过程中有缺陷,而且这类小鼠可抵抗内毒素休克【22,23】。研究发现,caspase-1 至少有六种同工型,其中包括 caspase-1 α、β、γ、δ、ε 和 ζ (6)。多数 caspase-1 同工型(α、β、γ 和 δ)生成的产物在 30-48 kDa 之间,并通过过表达诱导细胞凋亡。Caspase-1 ε 通常只包含 p10 亚基,不会诱导细胞凋亡,可作为一种显性失活蛋白。Caspase-1 中广泛表达的 ζ 同工型会诱导细胞凋亡,并且与 α 同工型相比,缺乏 39 个氨基末端残基【24】。caspase-1 通过炎症小体的寡聚化分子平台激活,此中包含 caspase-5、Pycard/Asc 和 NALP1【25】。
Interleukin-1β (IL-1β) 是 caspase-1 的重要靶标之一,也是一个参与许多免疫和促炎性反应的多功能细胞因子【26】。它主要由激活的单核细胞和巨噬细胞产生。它通过各种接头蛋白和激酶发出信号,从而激活大量下游靶标【27-31】。人 IL-1β 可以合成为 31 kDa 前体。为了获得活性,前体必须在 Asp116 和 Ala117 位点之间被 caspase-1 剪切产生 17 kDa 成熟形式【32,33】。IL-1β 17 kDa 成熟形式的检测是衡量 caspase-1 活性的一个很好指标。

分析完以上炎症小体研究相关靶点,你是否想到要更加经济地购买到该研究相关的多个靶点的抗体?CST 新推出了 Human Reactive Inflammasome Antibody Sampler Kit II #25620,可帮您探秘炎症小体相关的科研问题。这个产品包装里包括:
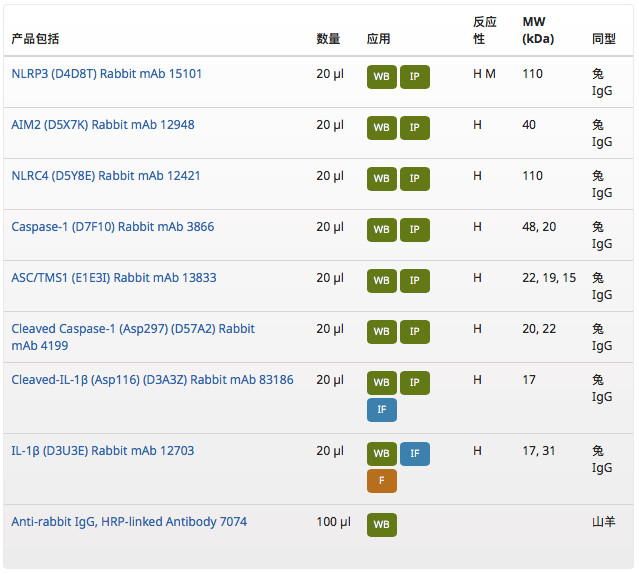
该产品的特点:
- 用于检测人样品当中的 NLRP3、NLRC4、AIM2、ASC/TMS1、Caspase-1(包含前体和切割活化型)、IL-1β(包含前体和成熟型)等多个分子;
- 小包装抗体,经济实用;
- 非常适合于初期炎症小体相关和 caspase-1 激活引起的炎症的信号通路的探索。
小编点评:
炎症小体是细胞焦亡以及其激活 caspase-1 引起的 IL-1β分泌的炎症反应的重要调控因素。除此之外,Gasdermin D 也是细胞焦亡下游信号通路的重要靶点,在各个领域中发挥的作用正亟待揭晓,也是目前研究的热点之一。
提示:
CST 出品了一系列不同研究领域的小包装抗体组合套装,广受大家欢迎,欢迎大家咨询,了解更多。
参考文献:
- Zhong Y et al. Front Immunol. (2013) 4:333.
- Broz, P. and Dixit, V.M. (2016) Nat Rev Immunol 16, 407-20.
- Guo, H. et al. (2015) Nat Med 21, 677-87.
- Jo, E.K. et al. (2016) Cell Mol Immunol 13, 148-59.
- Rathinam, V.A. and Fitzgerald, K.A. (2016) Cell 165, 792-800.
- Shao, B.Z. et al. (2015) Front Pharmacol 6, 262.
- Schroder, K. and Tschopp, J. (2010) Cell 140, 821-32.
- Mariathasan, S. et al. (2004) Nature 430, 213-8.
- Poyet, J.L. et al. (2001) J Biol Chem 276, 28309-13.
- Franchi, L. et al. (2006) Nat Immunol 7, 576-82.
- Miao, E.A. et al. (2006) Nat Immunol 7, 569-75.
- Miao, E.A. et al. (2010) Proc Natl Acad Sci U S A 107, 3076-80.
- Kofoed, E.M. and Vance, R.E. (2011) Nature 477, 592-5.
- Zhao, Y. et al. (2011) Nature 477, 596-600.
- Qu, Y. et al. (2012) Nature 490, 539-42.
- Roberts, T.L. et al. (2009) Science 323, 1057-60.
- Hornung, V. et al. (2009) Nature 458, 514-8.
- Fernandes-Alnemri, T. et al. (2009) Nature 458, 509-13.
- Thornberry, N.A. et al. (1992) Nature 356, 768-74.
- Martinon, F. and Tschopp, J. (2004) Cell 117, 561-74.
