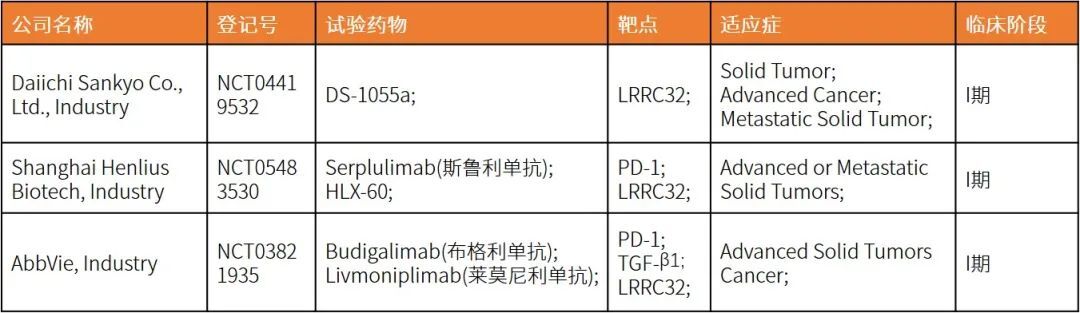
8月9日,CDE官网显示,复宏汉霖的HLX60临床试验申请获受理,用于治疗实体瘤。这是国内率先申报临床的GARP单抗。
GARP结构
GARP是一个72 kDa的I型跨膜蛋白,由662个氨基酸组成。其结构由三个区域组成:细胞外结构域,富含亮氨酸重复区域,约占蛋白的70%;疏水跨膜结构域;细胞质尾部有15个氨基酸残基。GARP的胞外部分包含20个LRR基序,由富含脯氨酸的区域和C端LRR分成两部分。两个半胱氨酸(位置分别为192和331,第7和第12 LRR)负责在GARP和LTGF-β中的LAP之间形成两个二硫键[1-2]。
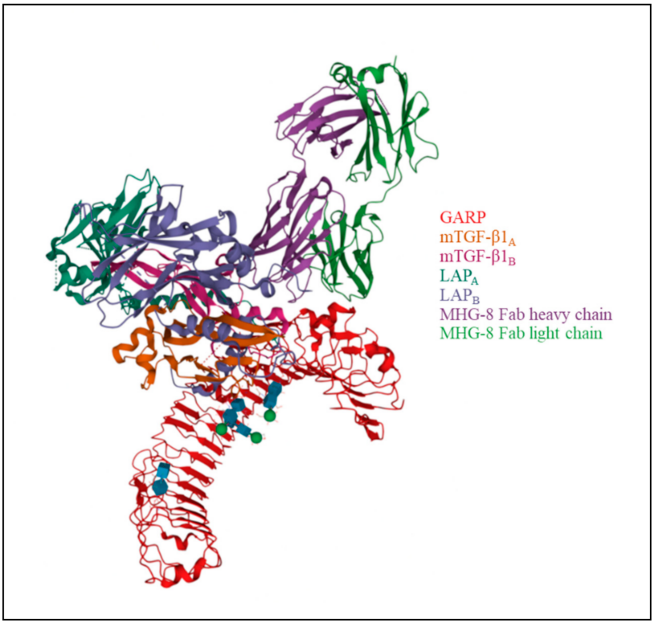
图1.GARP与LTGF-β1和MHG-8 Fab形成的复合物 (PDB: 6GFF)。LTGF-β1包含两个LAP(LAPA和LAPB)和两个mTGF-β1分子(mTGF-β1A 和 mTGF-β1B)[1-2]。
GARP促进TGF-β的激活
(A)Latent TGF-β (LTGF-β)。TGF-β以同源二聚体前体的形式合成,在高尔基体中被furin切割成LAP和成熟的TGF-β,它们以非共价结合,形成Latent TGF-β (LTGF-β,也称为小潜伏复合物)。这个复合物可以与LTGF-β结合蛋白(LTBP)结合成大潜伏复合物(LLC), LLC又与细胞外基质(ECM)结合,或GARP,使其能够在膜上表达。GARP需要ER伴侣Gp96才能折叠和表面表达。GARP引导小潜伏复合物(SLC)通过整合素αVβ8或αVβ6结合和释放。
(B)通过蛋白酶独立的方式激活TGF-β。在Gp96的帮助下,SLC-GARP复合物在细胞膜上表达后,整合素通过LAP上的RGD基序与LTGF-β结合。细胞收缩或机械张力引起表面LAP的变形,介导TGF-β成熟形式的释放。
(C)通过蛋白酶依赖的方式激活TGF-β。在Gp96的帮助下,SLC-GARP复合物在细胞膜上表达后,整合素通过自分泌或旁分泌途径招募金属蛋白酶(如MMP-14)或丝氨酸蛋白酶,它们切割LAP,从而释放TGF-β[1]。
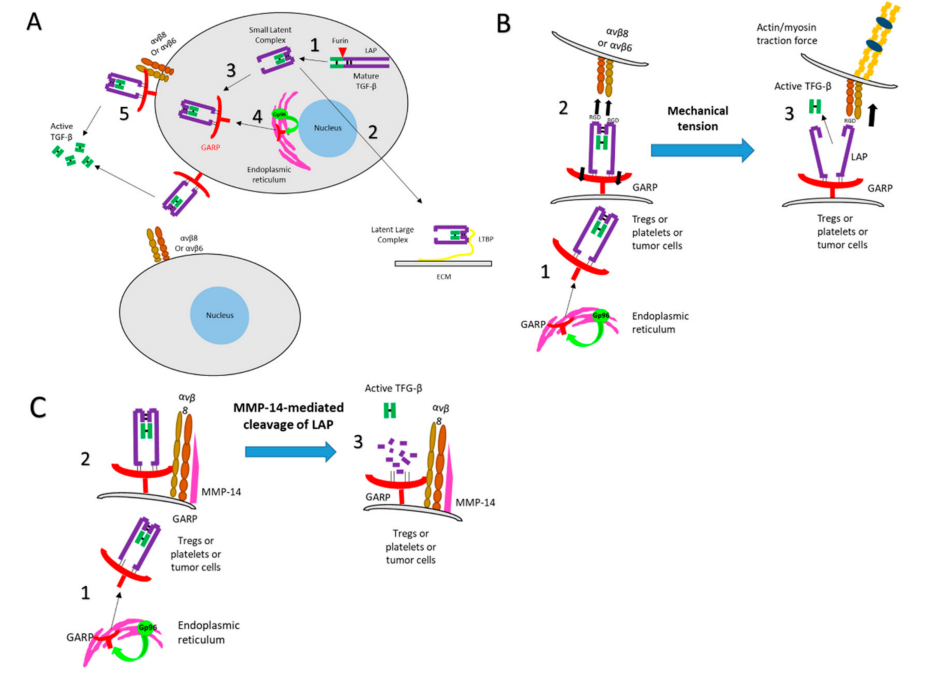
图2. 生物活性TGF-β释放的多步骤过程[1]
GARP 作为癌症的治疗靶点
GARP是LTGF-β的对接受体,促进LTGF-β的激活。在癌症中,许多预后不良的癌症中都出现了GARP表达的增加,无论是在肿瘤细胞中还是在TME细胞中,它都发挥着重要的作用,产生活性TGF-β,从而参与免疫抑制环境[1]。GARP 相比FoxP3的优势在于其表达于膜上适合使用治疗性抗体[3]。就其表达及其通过TGF-β激活的功能而言,GARP作为肿瘤靶标潜力巨大。
靶向GARP治疗策略
通过Treg增强GARP介导的抑制作用为治疗自身免疫性疾病和移植排斥提供了一种有希望的策略。
(1)方法1利用针对miRNA的抑制剂,靶向GARP mRNA。这样可以防止GARP mRNA的降解,从而增加GARP的表面表达,增强Treg的抑制能力。
(2)方法2应用sGARP诱导Treg。
(3)方法3将sGARP与LTGF-β联合利用它们的免疫抑制作用,并以整合素控制的方式促进TGF-β的激活。为了产生有效的抗肿瘤免疫反应,需要抑制Treg介导的抑制。
(4-5)方法4和5代表了两种不同的单克隆抗体(mAb)治疗策略,目前处于1期临床试验。方法4使用一种与GARP/TGF-β1复合物结合的IgG4抗体(ABBV-151),阻止成熟TGF-β1的释放。导致了TGF-β1信号的抑制,随后Treg抑制能力的降低,以及T效应细胞(Teff)功能的恢复。方法5采用一种岩藻糖基化IgG1抗体(DS-1055a),通过抗体依赖的细胞毒性有效地消耗GARP+ Treg,防止Treg介导的抑制并恢复Teff功能[3]。
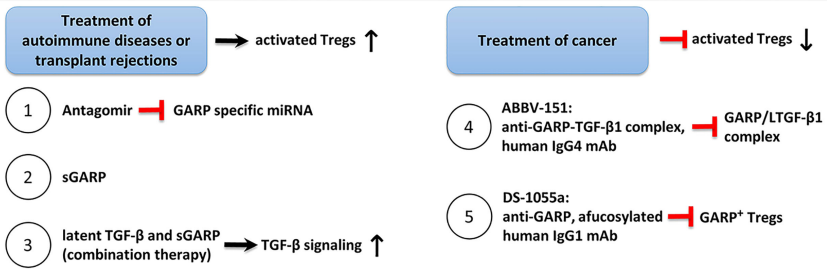
图3. 靶向GARP治疗策略
目前,全球仅有3款GARP单抗进入临床阶段,分别是HLX60、ARGX-115和DS-1055a。
近岸蛋白自主研发GARP、Latent TGF-beta 1&GARP Complex、Integrin以及TGF-β相关产品二十余种,可满足靶向GARP和TGF-β药物研发、功能评估和质量控制等不同环节的需求。
相关产品
|
Cat. No. |
Product Name |
|
Recombinant Human GARP/LRRC32 (C-Fc) |
|
|
Recombinant Human Latent TGF-beta 1&GARP Complex Protein (N-6His, C-3*Strep) |
|
|
Recombinant Human Integrin alpha V beta 8 Heterodimer (C-6His) |
|
|
Recombinant Human TGF-beta 1 |
|
|
Biotinylated Human TGF-beta 1 (N-Avi) |
|
|
Recombinant Mouse/Rat TGF-beta 1 |
|
|
Recombinant Human TGF-beta 2 |
|
|
Biotinylated Human TGF-beta 2 (N-Avi) |
|
|
Recombinant Mouse/Rat TGF-beta 2 |
|
|
Recombinant Human/Mouse/Rat TGF-beta 3 |
|
|
Biotinylated Human TGF-beta 3 (N-Avi) |
|
|
Recombinant Human LAP (TGF-beta 1) |
|
|
Biotinylated Human LAP (TGF-beta 1) (N-6His-Avi) |
|
|
Recombinant Human Latent TGF-beta 1 (N-6His) |
|
|
Recombinant Mouse Latent TGF-beta 1 (N-8His) |
|
|
Biotinylated Mouse Latent TGF-beta 1 (N-8His-Avi) |
|
|
Recombinant Cynomolgus Latent TGF-beta 1 (N-6His) |
|
|
Biotinylated Human Latent TGF-beta 2 (N-8His-Avi) |
|
|
Biotinylated Human Latent TGF-beta 3 (N-8His-Avi) |
|
|
Recombinant Human TGFBR1(C-Fc) |
|
|
Recombinant Mouse TGFBR1 (C-Fc) |
|
|
Recombinant Human TGFBR2 (C-Fc) |
|
|
Recombinant Mouse TGFBR2 (C-6His) |
|
|
Recombinant Mouse TGFBR2 (C-Fc,Ile24-Asp184) |
|
|
Recombinant Mouse TGFBR2 (C-Fc,Ile24-Asp159) |
|
|
Recombinant Mouse TGFBR3 (C-6His) |
|
|
293-TGFβ Res 细胞株(DMEM) |
参考文献
1. Bouchard, Alexanne et al. “GARP: A Key Target to Evaluate Tumor Immunosuppressive Microenvironment.” Biology vol. 10,9 836. 27 Aug. 2021, doi:10.3390/biology10090836
2. Liénart, Stéphanie et al. “Structural basis of latent TGF-β1 presentation and activation by GARP on human regulatory T cells.” Science (New York, N.Y.) vol. 362,6417 (2018): 952-956. doi:10.1126/science.aau2909
3. Zimmer, Niklas et al. “GARP as a Therapeutic Target for the Modulation of Regulatory T Cells in Cancer and Autoimmunity.” Frontiers in immunology vol. 13 928450. 8 Jul. 2022, doi:10.3389/fimmu.2022.928450
苏州近岸蛋白质科技股份有限公司,是一家专注于重组蛋白应用解决方案的高新技术企业,主营业务为靶点及细胞因子类蛋白、重组抗体、酶及试剂的研发、生产和销售,并提供相关技术服务。公司定位为医疗健康与生命科学领域原料与技术解决方案的上游供应商,致力于为下游客户提供及时、稳定、优质的产品及服务,助力全球生物医药企业和研究机构的技术与产品创新升级。
访问www.novoprotein.com.cn或致电400-600-0940。
