
期刊:Nature
影响因子:69.504
导语
大约30-40%的接受了原发性肿瘤根治性切除术的结直肠癌(colorectal cancer CRC)患者将在几年后发生转移。重要脏器的转移及术后复发仍是主要的致死原因。然而,目前仍缺乏有效的疗法来消除残余的肿瘤细胞,以防止预后不佳的结肠癌转移和复发。研究预防CRC复发的疗法仍然迫在眉睫。
研究技术
10x scRNA-seq、RNA-seq、多色免疫荧光
研究内容
该研究通过构建类人CRC转移复发模型以及细胞追踪系统,发现了一群高表达EMP1的细胞群对于CRC原位切除后转移复发起关键作用。首次发现了隐藏在肝脏和肺部中的残余肿瘤细胞,并揭示了这些残余细胞如何演变为肝肺器官中出现的转移瘤。
研究路线
研究结果
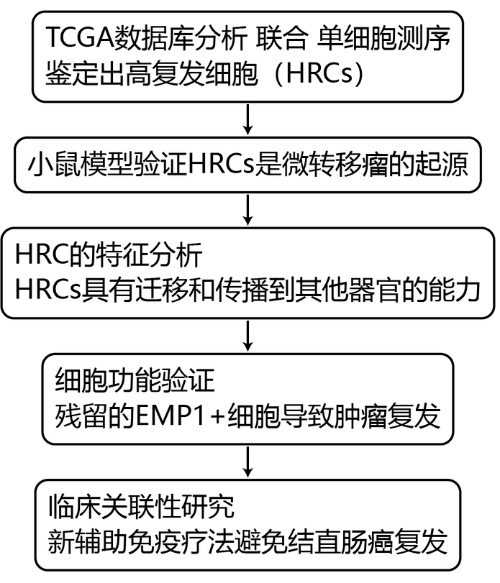
1. 高复发细胞(HRCs)的鉴定
作者对大量RNA-Seq的数据(其中包括TCGA数据库和6个公共 CRC 转录组数据集)进行整合分析一共获得1830个样本,确定了HR > 1和 P < 0.05的2,530个预测疾病复发的基因(图1a),并发现其中有99个基因(在下文中被称为上皮特异性高风险基因集,EpiHR)显示出肿瘤上皮细胞限制特异性上调表达(图1b-d)。通过UMAP分析,研究发现27个CRC患者中有18个含有EpiHR基因集标记的细胞(图1f-h),并将这个肿瘤细胞群称为高复发性细胞(HRCs)。对HRCs 与非 HRCs进行差异表达分析并通过基因富集分析,发现HRCs与缺氧、细胞间粘附、细胞外间质、肌动蛋白细胞骨架和调节细胞迁移有关通路显著富集(图1i)
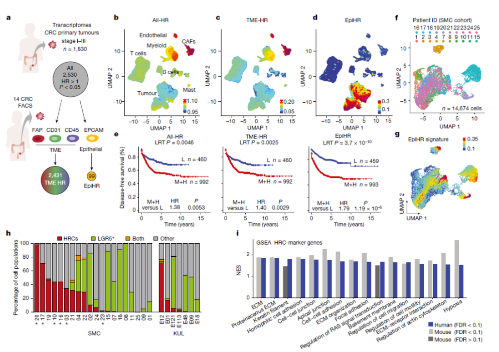
Fig 1. 鉴定预后差的上皮CRC细胞
2. 转移性细胞状态的动态变化
作者用一种新的转移性复发小鼠模型,研究 HRC 对转移性复发的贡献,模拟手术切除原发肿瘤后发生转移性复发的过程,分析在切除原发性CRC后检测肝脏中转移细胞的变化,确定肝脏中有微转移、小转移和大转移(图2a-d)。UMAP 显示原发肿瘤和转移瘤的肿瘤细胞在很大程度上是重叠的(图 2e,f)),聚类分析确定了六个细胞亚群(图2g)()。接下来,研究人员通过轨迹推断算法 CellRank在转移进展过程中预测了HRCs是微转移瘤的起源(图2i-t)。

Fig 2. CRC转移的时空动态变化
3. HRC的特征分析
通过分析人和小鼠的scRNA-Seq数据集,发现人鼠CRC中的HRCs 一致地表达了核心基因的大部分子集,其中,EMP1在 HRCs 中高表达,利用Emp1来追踪肿瘤复发期间的HRCs,发现EMP1-TOMhigh的细胞群处于侵袭部位的前沿以及肿瘤出芽部位,HRCs具有迁移和传播到其他器官的能力,细胞在向外转移生长后会产生非HRC细胞群(图3b-k)。
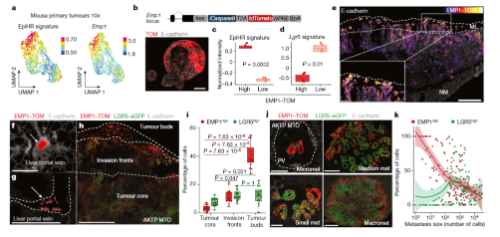
Fig 3. EMP高表达细胞富集于侵袭前端和转移灶
4. 残留的EMP1+细胞导致肿瘤复发
利用插入 Emp1基因座的诱导型caspase-9在肿瘤中进行细胞消融实验,通过DIM治疗特异性剔除高表达EMP1的肿瘤细胞(图4a-e)。结果表明在原发性肿瘤生长期间进行DIM治疗,大多数小鼠没有出现肝和肺转移现象,而在原发性肿瘤切除一周后进行DIM治疗,所有小鼠都出现转移复发(图4f-l)。由此可见,在原发性CRC切除后,EMP1high HRCs会导致肿瘤的复发转移,但在转移完成后,这类细胞并非肿瘤生长必须的。
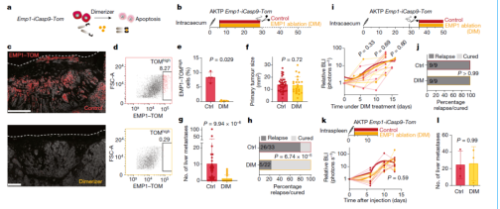
Fig 4. EMP1high细胞是远端转移的起源
5. 新辅助免疫治疗可以避免复发
假设在类器官定植开始时,缺乏成熟的 TME 使 HRCs 暴露于后天免疫系统,但扩散的细胞通过免疫调节分子绕过免疫攻击。为了测试微转移性疾病对免疫治疗的易感性,用抗 PD1抗体联合抗 CTLA4抗体治疗小鼠,即在手术切除原发肿瘤之前(图5k–p)。这种方法增加了原发性结直肠癌中 CD8+细胞毒性T细胞的数量(图5l,m),但是肿瘤生长速率不变,无转移发生(图5o-p)。相比之下,手术后2周应用相同的治疗方案并不能阻止转移性肿瘤的生长(图5s),这与在转移性微卫星稳定的 CRC 患者中观察到的检查点免疫治疗失败相一致。因此,在转移定植后的时间窗内,免疫治疗能有效地消除残留疾病并防止随后的转移复发。
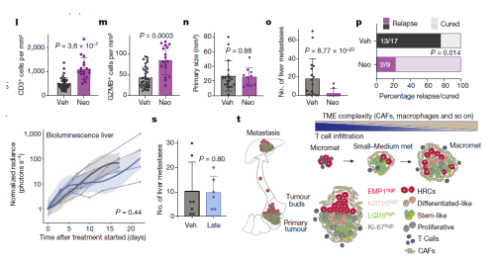
Fig 5. 新辅助治疗抑制CRC远端复发
总结
本研究通过构建CRC类人小鼠转移复发模型,揭示了一群EMP1高表达的HRC细胞对于转移定植至关重要,而LGR5+干细胞样肿瘤细胞对于CRC转移后的生长起关键作用。揭示了 CRC 残留疾病的细胞状态动力学,并预期针对 HRCs 的治疗可能有助于避免转移性复发。为消除残余病变,开发新的诊断工具和新疗法提供了新的思路。
参考文献:
Cañellas-Socias A, Cortina C, Hernando-Momblona X, Palomo-Ponce S, Mulholland EJ, Turon G, Mateo L, Conti S, Roman O, Sevillano M, Slebe F, Stork D, Caballé-Mestres A, Berenguer-Llergo A, Álvarez-Varela A, Fenderico N, Novellasdemunt L, Jiménez-Gracia L, Sipka T, Bardia L, Lorden P, Colombelli J, Heyn H, Trepat X, Tejpar S, Sancho E, Tauriello DVF, Leedham S, Attolini CS, Batlle E. Metastatic recurrence in colorectal cancer arises from residual EMP1+ cells. Nature. 2022 Nov;611(7936):603-613. doi: 10.1038/s41586-022-05402-9. Epub 2022 Nov 9. PMID: 36352230.
