作为近几年兴起的突破性技术,mRNA技术通过脂质纳米颗粒( LNP )将mRNA导入体内来表达抗原蛋白,以刺激机体产生特异性免疫反应。新冠肺炎疫情( COVID-19 )爆发后,针对性的mRNA疫苗在多种疫苗类型中脱颖而出。与此同时,环状RNA( circRNA )以其高度稳定的结构,不需要修饰核苷酸和加帽加尾修饰等优势,逐渐走入大众视野,并迅速引发资本市场和业内研究人员的高度关注。
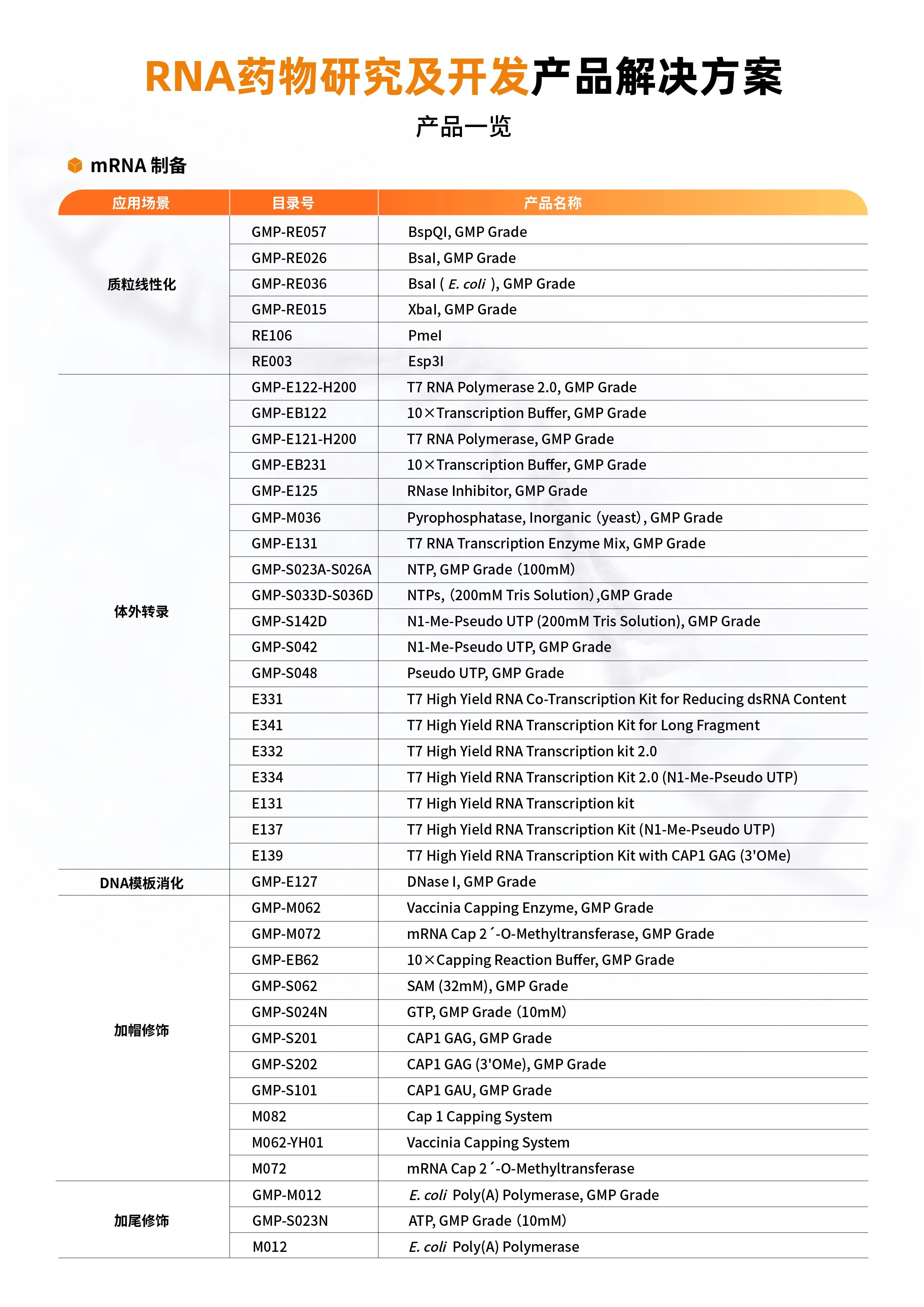
circRNA 技术路线:
1 模板制备
在该环节中,高质量的质粒制备尤为重要,关系到后续体外转录产物的质量。环状质粒由于无有效的终止,会转录出不同长度的RNA产物。为了得到特定长度的RNA,质粒必须完全线性化,线性化的质粒需确保双链为平末端或5’端为突出结构。此外,为了使转录产物中不带有酶切位点残基序列,通常质粒线性化时需要使用IIS型限制性内切酶进行质粒酶切。近岸蛋白提供GMP级生产BsaI(Cat#GMP-RE026)、BspQI(Cat#GMP-RE057)和XbaI(Cat#GMP-RE015)限制性内切酶,高效线性化质粒。
1.1 Bsa I,GMP Grade,Cat#GMP-RE026
限制性内切酶Bsa I 特异性识别双链DNA中位点并进行酶切,可将模板质粒酶切线性化,制备mRNA体外合成模板;
酶切位点:
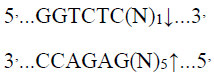
产品特点:
-
强特异性;
-
受CpG、Dcm甲基化影响,剪切阻断;
-
受EcoBI甲基化影响,剪切可能受影响;
-
不受Dam甲基化影响。
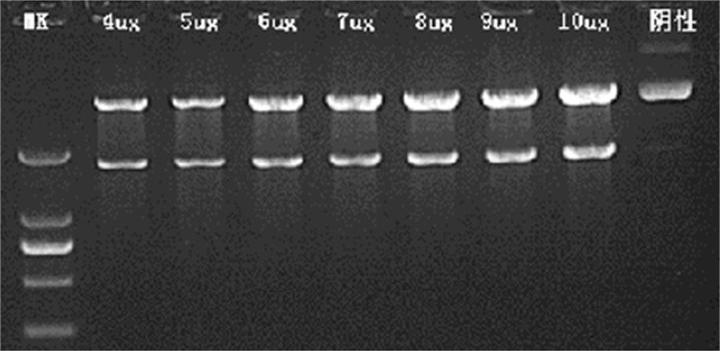
50μl 酶切体系内,1U BsaI 引入量前提下,调整质粒加量进行酶切,结果显示 BsaI 可完全酶切 10μg 质粒。受质粒类型及超螺旋比例等因素影响,酶切效率有较大差异,需根据实际情况调整酶切体系。
1.2 BspQI, GMP Grade,Cat#GMP-RE057
限制性内切酶BspQI特异性识别双链DNA中位点并进行酶切,可将模板质粒酶切线性化,制备mRNA体外合成模板;
酶切位点:
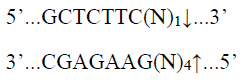
产品特点:
-
对Dam、Dcm和哺乳动物CpG甲基化不敏感。
-
BspQI的同裂酶有LguI、PciSI、SapI。
1.3 XbaI, GMP Grade,Cat#GMP-RE015
限制性内切酶XbaI特异性识别双链DNA中位点并进行酶切,可将模板质粒酶切线性化,制备mRNA体外合成模板;
酶切位点:
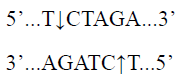
2 RNA 体外转录
此步以DNA为模板,在体外由RNA聚合酶催化合成mRNA。
2.1 T7 RNA Polymerase, GMP Grade,Cat#GMP-E121,Cat#GMP-E122
作为生物大分子,mRNA可通过体外转录(IVT,in vitro transcription)的方法大规模合成,T7启动子是目前转录效率最高的启动子之一,因此采用T7 RNA Polymerase进行体外转录可简单快速获得大量的RNA分子。T7 RNA Polymerase是体外转录生产治疗用mRNA的关键酶。
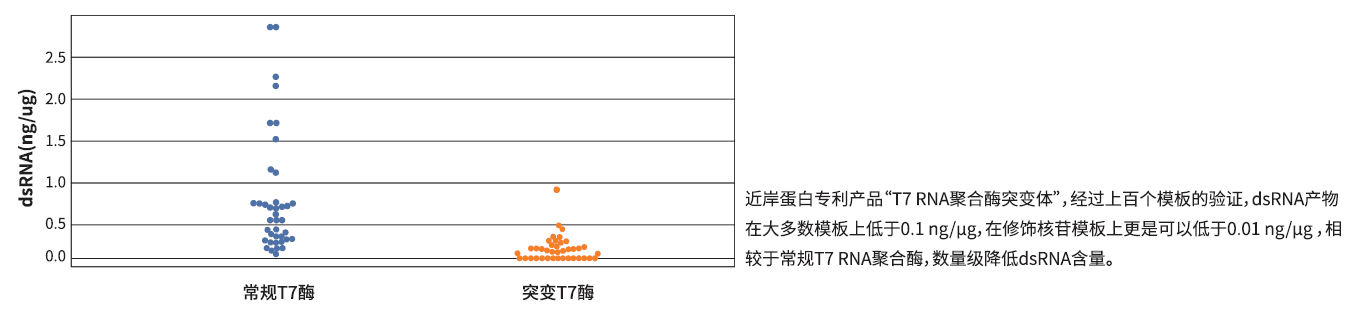
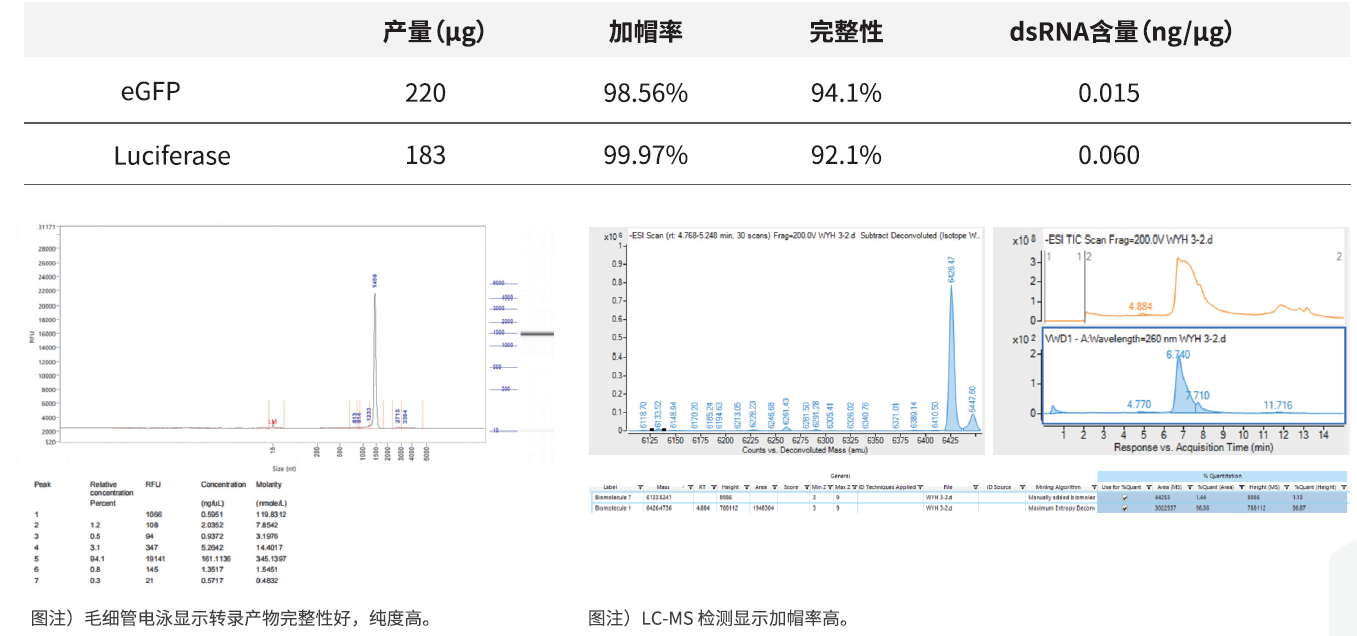
dsRNA作为体外转录的副产物之一,能够被对应的核酸受体识别,引发天然免疫炎症反应,严重影响mRNA疫苗的效果,在生产过程中需要严格控制。经分子进化改造获得的T7 RNA聚合酶突变体(目录号:GMP-E122)可明显降低转录产物中dsRNA的含量。
产品特点:
-
有效降低dsRNA含量
-
产量高,150-250μg/20μl反应体系
-
共转录体系加帽率高
-
可转录不同长度片段,产物完整性好
2.2 RNase inhibitor, GMP Grade,Cat#GMP-E125
RNase Inhibitor可与RNase A形成1:1复合体,对RNase 有极强非竞争性抑制,保护mRNA转录后不被降解
产品特点:
强抑制RNase活性;
稳定性强,适合更高转录温度体系探索。
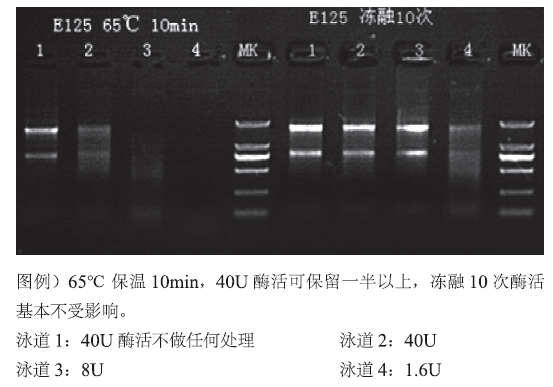
2.3 Pyrophosphatase, Inorganic (yeast), GMP Grade,Cat#GMP-M036
RNA体外合成过程中加入无机焦磷酸酶,增加RNA产量。
Pyrophosphatase, Inorganic可催化无机焦磷酸盐水解生成P2O74-+H2O+PPase→2HPO42-,一方面可去除无机焦磷酸盐对反应体系的抑制,另一方面为反应提供热力学动力,促进产物的生成,在mRNA疫苗体外大规模合成中加入可显著提高产量。
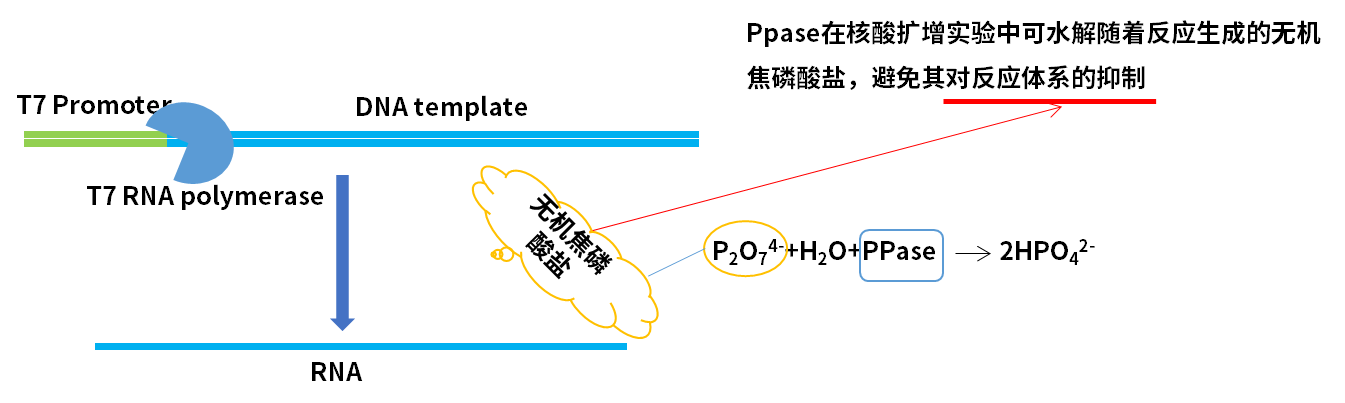
2.4 核苷酸,Cat#GMP-S033-036D
核苷三磷酸( NTP )可用于分子生物学中多种相关应用;
3 模板去除(DNaseI, GMP Grade,Cat#GMP-E127)
此步为RNA转录结束后,双链DNA模板去除
4 RNA环化
环化工艺有三种不同的制备方法,不同的方式、不同的RNA长度都可能带来不同的环化效率。以I型内含子为基础,搭配有助于剪接的辅助序列,可实现环化1500nt以上的RNA。II型内含子剪接有酵母菌或破伤风杆菌来源,Ⅱ型内含子的自催化剪接反应可以在体外人工制备环状RNA,利用Ⅱ型内含子的六个结构区域中的(D1-D3)以及(D5-D6)序列倒转,可以形成自剪接活性的核酶,此种方法制备的环状RNA没有外来序列的残留。通过酶法环化可以避免外源序列引入导致的免疫原性,同时发展了借助内源性的夹板链实现RNA的环化。
近岸蛋白提供GMP级T4 RNA Ligase 2(Cat#GMP-M050),助力circRNA药物开发及申报。
5 circRNA 纯化
环化结束后,需要通过系列纯化手段对circRNA进行高纯度回收,由于不同环化方式的效率差异,RNase R的引入,有效去除未环化的线性RNA,从而达到纯化circRNA的目的。RNase R几乎能够消化所有线性的RNA,但不易消化环状RNA、套索结构RNA和3'端突出少于7个核苷酸的短双链RNA分子。近岸蛋白经过系列验证,重磅推出高活性RNase R(Cat#GMP-E224)。
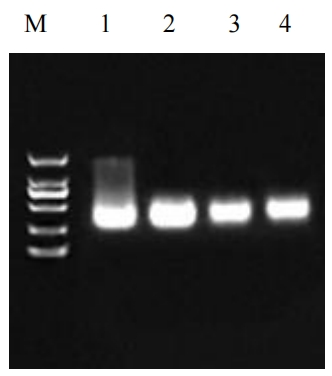
qRT-PCR 验证实验
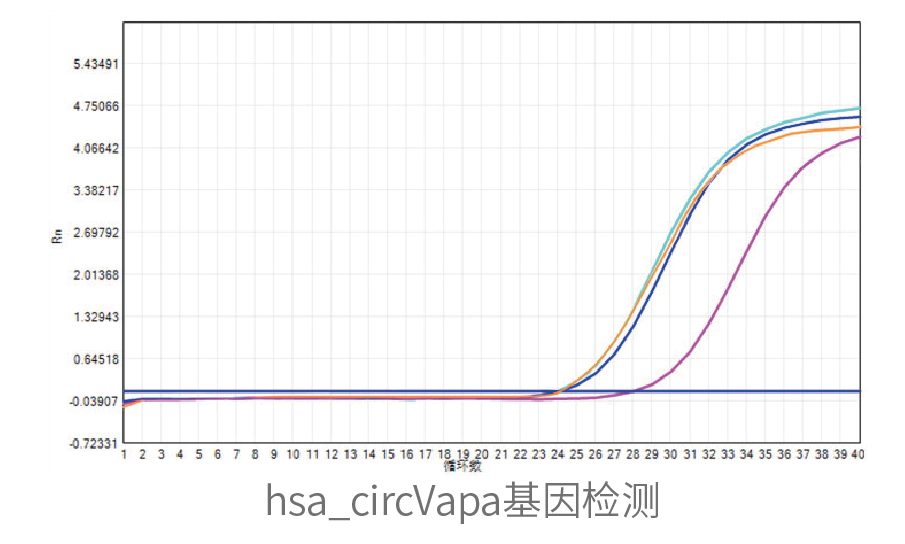
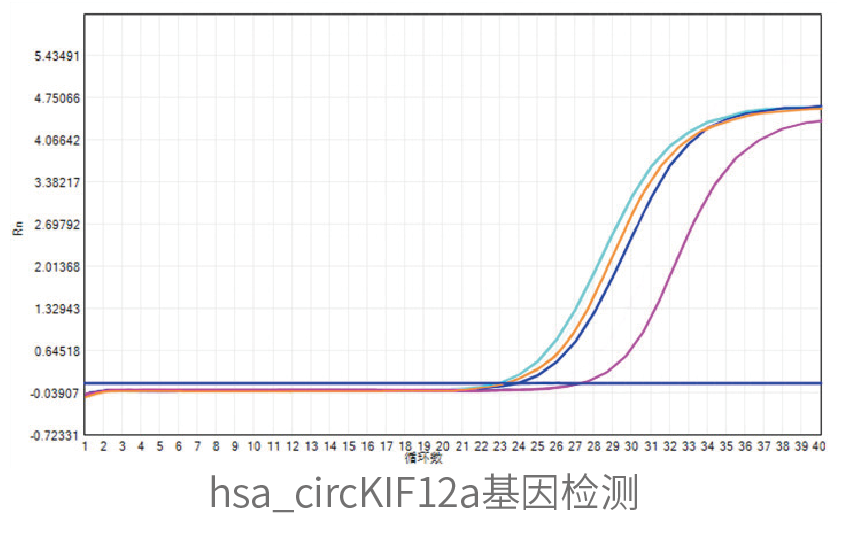
细胞表达验证
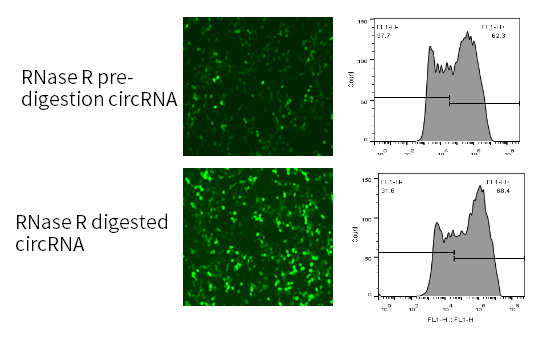
经RNase R消化后的eGFP circRNA转染细胞后,表达量更高。
产品信息