细胞间的差异存在于任何细胞群体中,此前对细胞机制的理解还依赖于对大量细胞群体的测定。现在人们普遍认为,总体平均值可能不代表单个细胞功能,因此需要用单细胞分辨率来解析细胞“组学”(例如,基因组学、表观基因组学、转录组学、蛋白质组学、代谢组学等)。近来,单细胞DNA和RNA测序的发展使其能够以单细胞分辨率监测细胞谱系和细胞异质性。然而,即使是等基因细胞(即具有相同基因型的细胞)也可能表现出随机的细胞异质性。代谢产物和其他成分浓度的非遗传性细胞差异会影响细胞死亡易感性、动力学,甚至是对统一致命药物暴露的死亡模式。在癌症治疗中,连续几轮细胞毒性化疗通常会杀死肿瘤中一定比例的细胞,而不是绝对数量的细胞,这表明要么是预先存在的细胞异质性抑制治疗,要么是细胞亚群对治疗的选择性反应,也就是说非遗传细胞异质性对治疗和治疗的总体疗效有明显影响。
用单细胞分辨率检测代谢物是很大的挑战。在一个细胞内,有数千种独特的化学物质以低浓度存在,且这些化学物质可以迅速变化,与单细胞基因组学和转录组学不同,代谢物没有可用的扩增策略,若想获得足够的单细胞数据以统计区分细胞群体或亚群体之间的差异,高灵敏度,高的单细胞采样吞吐量是必需的。流式细胞术是最常用的单细胞测定技术之一,使用基于荧光的分子探针,以极高的通量(数千个细胞/秒)分析特定代谢物,但由于光谱特征重叠,流式细胞术只能同时测定大约十几个分子。使用基于重金属同位素的分子探针组合,流式细胞仪可以靶向多达48个不同的分子组分,但这仍然只代表单个细胞中存在的代谢物的一小部分。不幸的是,通过流式和质谱细胞术进行无靶向分子分析是不可行的,即研究人员必须事先知道并选择要研究的分子。
质谱(MS)由于其高灵敏度、化学特异性和速度是最适合非靶向单细胞分析的技术之一。目前已有几种基于真空和探针的质谱技术,以实现对单细胞的全面、无靶化学分析,包括二次离子质谱(SIMS)、基质辅助激光/解吸电离(MALDI)和激光/解吸离子化(LDI)技术,这些技术虽然非常敏感,但需要在细胞的自然状态之外对其进行重大修改(例如固定和脱水),以便于在真空下进行分析。还有几种方法,包括活单细胞质谱、单探针质谱和其他方法,使用手动引导的探针(移液器、光纤、毛细血管等)在原位或体内通过环境质谱测定细胞化学,然而,低采样通量限制了大多数这些方法的使用,因为每个细胞的测定都很费时。
随着技术的进一步发展,基于MS的技术成为快速、定量和非靶向单细胞化学分析所需技术的基础。然而,单细胞化学的常规定量测定仍然具有挑战性。此外,为了便于分析,目前的MS平台需要广泛的样品制备程序或以其他方式干扰细胞的天然状态,这可能会对细胞化学产生不可预见的影响。为了解决这些问题,此报道开发了一种新的单细胞化学分析能力,利用单细胞液滴分配,然后用常压溶剂萃取-MS方法进行化学分析。本文证明了单细胞打印机液体涡流捕获MS(SCP-LVC-MS)系统可以高采样通量定量测定单个微藻和哺乳动物细胞的脂质组学特征,并在分析之前不需要对细胞本身进行任何修饰。
SCP-LVC-MS技术的工作原理是通过SCP技术进行单细胞分离,然后将液滴捕获到LVC-MS采样探针中,一旦暴露于适当的溶剂中,细胞就被裂解、提取并通过MS进行分析。SCP是一种台式自动液滴式细胞打印机,利用类似喷墨的分配原理与光学显微镜相结合,含有>1个或没有细胞的液滴可以通过成像显微镜识别,并通过真空吸出,确保每滴喷出一个细胞,在实践中,>95%的喷出液滴含有单个细胞。SCP系统放置在Sciex TripleTOF®5600+质谱仪的顶部(图1d),LVC探针连接在SCP系统的底座上(图1c)。cartridge在LVC探针正上方1mm处对齐(图1c),确保探针捕获所有用于分析的液滴。LVC-MS是一种利用连续流动液体溶剂萃取的常压MS技术,LVC-MS技术使用同轴管设计,当在优化的溶剂和喷雾器气体条件下操作时,在探针的采样端保持稳定的液体涡流排放(图1c),与液体涡流表面接触的分析物在几秒钟内被捕获、提取并输送到质谱仪的电离源。随后,使用电喷雾电离(ESI)、大气压化学电离(APCI)或几乎任何基于液体的电离源对分析物进行电离,并通过MS进行检测。在该配置中,含有单个细胞的液滴朝着LVC探针落下,该探针位于液滴喷出部位的正下方(图1b),液滴被液体涡流捕获,其中细胞在暴露于溶剂(例如甲醇等)时,由于渗透压的变化而破裂,细胞的内容物在运输到质谱仪的电离源(~6s),分析物分子被离子化,然后使用MS以非靶向(例如,飞行时间(TOF)-MS)或靶向(如,串联MS)方式进行测定。由于LVC探针是连续工作的,探针是自清洁的,去除了从一个细胞到另一个细胞的信号携带,并且可以容易地确定溶剂离子或由介质引起的离子的背景测定。这种方法的独特之处在于,细胞一直保持在其“自然”状态(在这种情况下是在生长培养基中),直到LVC-MS进行裂解和化学分析。此外,SCP-LVC-MS技术不需要分子标记或其他样品制备方案,质谱仪和电离源的操作方式与通常用于测定细胞群体中细胞化学的直接注入ESI实验的操作方式完全相同。
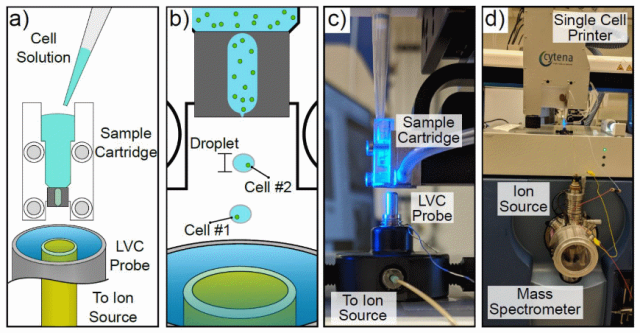
图1:SCP-LVC-MS系统概述
为了评估SCP-LVC-MS系统测定单细胞化学图谱的能力,作者使用了直径约为5-15μm的CC-125野生型mt+[137c]ChRe微藻,在不稀释或不对细胞悬浮液进行其他改变的情况下,将ChRe细胞悬浮液移液到SCP芯片中,放置在SCP分配器上,并调整液滴喷射设置,在1分钟窗口内对9个细胞取样时的总离子色谱图(TIC)如图2a所示,TIC中的每个信号尖峰对应于单个细胞的分析。该过程仅允许包含单个细胞的液滴落入LVC-MS探针中,在t=0.55分钟时,细胞液滴喷射前后的喷嘴图像(用“*”表示图2a)分别如图2b和c所示。收集同一细胞的TOF-MS以及三次SWATH-MS扫描,在TOF-MS光谱中观察到数十个离散离子(图2d)。图2e-g是基于单独的串联质谱实验和SWATH-MS扫描结果,在同一细胞的SWATH-MS质谱中可以观察到相关分子的特征碎片离子。
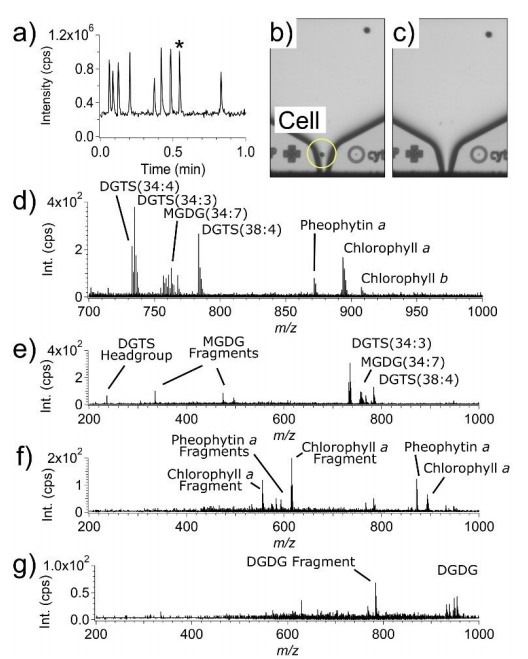
图2.ChRe微藻单细胞的SCP-LVC-MS分析
除此之外,SCP-LVC-MS技术也在其他类型细胞上得到了验证,获得了另外一种微藻EuGr以及HeLa细胞(源于宫颈癌症的常用人类上皮细胞系)的单细胞质谱。将细胞悬液直接从其培养基或储存介质(分别用于EuGr和HeLa细胞的HSM和磷酸盐缓冲盐水(PBS))移液到各自的SCP芯片中,并通过LVC探针进行采样。除了稀释HeLa细胞悬浮液之外,在分析之前的任何一个实验中都没有使用样品制备(过滤、离心、固定等)。EuGr和HeLa实验的TIC轨迹分别如图3a和3b所示。EuGr细胞直径约20μm,呈椭圆形(图3d),细胞的活性突出表明,它们从自然状态一直到LVC探针捕获点都没有受到干扰,EuGr细胞的TOF-MS光谱如图3g所示。单个HeLa细胞(直径约15μm)的图像和质谱分别如图3f和3h所示。
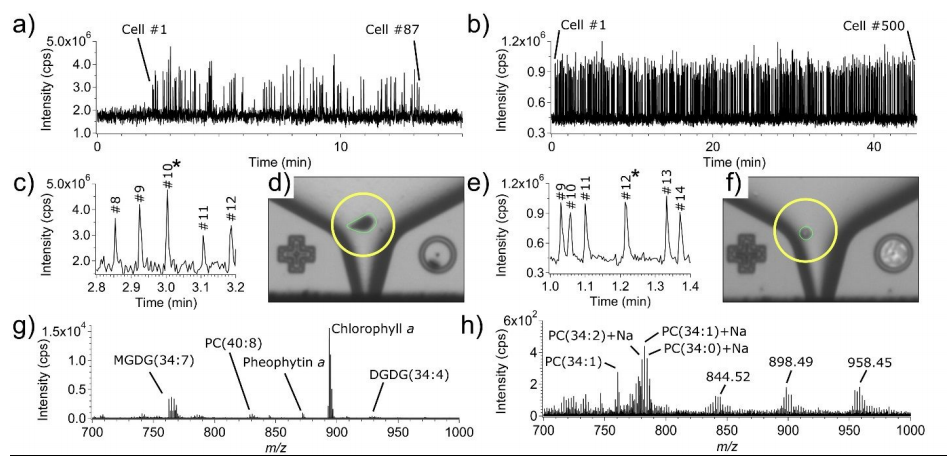
图3.Euglena gracilis和HeLa细胞的单细胞分析
这些数据共同突出了SCP-LVC-MS系统测定藻类和哺乳动物细胞类型的单细胞化学的能力。该过程除了稀释之外没有采取额外样品制备措施,通过对每种培养基的空液滴进行采样评估,发现几乎没有产生细胞中测定到的脂质信号,这表明脂质信号来自LVC探针中裂解的细胞,也表明用于稀释的培养基在该m/z范围(700-1000)内对单细胞质谱的影响通常可以忽略不计。
SCP-LVC-MS系统的独特之处在于,相对于其他非靶向MS单细胞方法,能够以高采样吞吐量以非靶向方式测定单细胞。SCP-LVC-MS系统的可行性通过测定微藻及HeLa细胞在其天然生长培养基中的脂质组成被验证。在单个细胞中观察到大量的二酰基甘油基三甲基高丝氨酸(DGTS)、磷脂酰胆碱(PC)、单半乳糖基二酰基甘油(MGDG)和二半乳糖基甘油(DGDG)脂质。该文还进行了其他实验以证实不同单细胞脂质存在明显差异以及以单细胞分辨率解决细胞群体差异的能力。
综上,本文献报告了一种方法,该方法通过单细胞打印机技术和液体涡流捕获质谱法(SCP-LVC-MS)的结合,无需额外的样品制备程序(如分子标记),即可对细胞悬浮液中的单细胞进行无靶向、高通量和定量质谱分析。

参考文献:
Cahill JF, Riba J, Kertesz V. Rapid, Untargeted Chemical Profiling of Single Cells in Their Native Environment. Anal Chem. 2019 May 7;91(9):6118-6126. doi: 10.1021/acs.analchem.9b00680. Epub 2019 Apr 19. PMID: 30955322.
