各位大朋友小朋友儿童节快乐呀,这里是儿童节也想咕咕的椰球。今天为大家带来的研究是一项功能神经环路研究。论文的标题简洁明了,为疼痛通过脊髓-臂旁核-中脑环路调控多巴胺神经元。本文发表于自然·神经科学,第一作者是目前就职于浙江大学的杨鸿斌博士。

在本文中,作者鉴定了一条从脊髓出发途径臂旁核(LPB)投向中脑的神经环路,并揭示了疼痛信号通过该环路调控多巴胺神经元活动的神经机制。研究发现,部分臂旁核神经元接受脊髓上行的伤害感受性信号并将其传递给中脑的黑质网状部(SNR)。而SNR则通过直接和间接两种不同的机制调控腹侧被盖区(VTA)多巴胺神经元的活动。本研究发现了连接感觉系统和多巴胺系统之间的“桥梁”,有利于帮助我们更深入理解疼痛对学习和认知行为的调控机制。
引言
疼痛是一种复杂的综合性现象。狭义的疼痛可能只是一种躯体对伤害性刺激的感觉反应,但临床上疼痛患者往往还伴有动机行为缺失等负面情绪,甚至会导致焦虑抑郁等心理问题。这提示“疼痛”这一概念除了感觉方面的表现外,还会伴有情绪和认知反应的改变。
位于中脑腹侧被盖区(ventral tegmental area,VTA)的多巴胺(dopamine,DA)神经元在奖赏和和动机行为相关的环路中发挥的作用已经为我们所熟知了。不少研究证据显示,不论是急性还是慢性疼痛都会导致VTA中多巴胺神经元活动的下降,从而进一步引发疼痛所带来的负面的情绪反应。然而在这一过程当中尚有一些问题悬而未决。其中最为关键的两个关键科学问题是:
01 外周伤害感受器上行的痛觉信号是通过何种通路被传递给VTA多巴胺神经元的?
02 疼痛调控多巴胺神经元活动的神经机制是怎样的?
为了更好地理解疼痛对认知行为的影响,以上这些问题依然值得深入挖掘。
在痛觉信号的传入通路中,臂旁核(lateral parabrachial nucleus,LPB)起到了重要的枢纽作用。研究表明,臂旁核可以对多种伤害性刺激产生反应,并将接收到的感觉信息分发到掌管不同生理过程的关键脑区,其中就包含了VTA。因此不难作出假设:臂旁核有可能在感觉信号传输到多巴胺神经元这一过程中扮演了“中转站”的角色。
接下来,就让我们具体来看研究者如何从臂旁核出发,对这条沟通感觉系统和认知系统之间的通路进行解析。
结果
不论是解读还是设计功能神经环路类的研究,我们大体上可以按照一个“先示踪,再记录,最后操纵”的思路对感兴趣的科学问题进行分析。具体而言,我们可以首先采用神经示踪技术鉴定目标神经环路的解剖学结构并利用电生理记录手段确定该环路的生理基础;然后使用电生理记录和钙成像等记录手段获取该环路在特定生理或病理过程中的活动规律;最后使用光遗传/化学遗传等手段结合行为学对目标环路的活动进行操纵,从而揭示其与特定生理或病理过程的因果关系。
回到文中,作者首先对LPB与中脑不同结构之间的解剖学联系进行了鉴定。值得注意的是,当我们设计神经示踪实验研究不同脑区之间的投射关系,尤其是涉及LPB和VTA这样连接比较复杂的结构时,我们必须同时获取顺向示踪(anterograde)和逆向示踪(retrograde)两种示踪手段的证据,互相印证才能将各脑区间的解剖学联系阐明。具体到本文,作者首先采用AAV病毒顺向不跨突触示踪结合目前非常热门的荧光显微镜光学切片断层成像系统(fMOST)分别绘制了LPB的谷氨酸能神经元和GABA能神经元向全脑的投射分布(图1a)。结果显示LPB的谷氨酸能神经元末梢分别投射向了VTA和SNR(黑质网状部)的外侧(图1b和c),而GABA能神经元则缺乏向中脑的投射。而在逆向示踪部分,研究者分别采用了犬腺病毒2(CAV-2)和伪狂犬病毒(RV)两种不同的手段确定了投向VTA、SNR的LPB神经元的空间定位。结果显示投向VTA和SNR的LPB神经元在空间上属于彼此分离的两群细胞(图1d和e)。
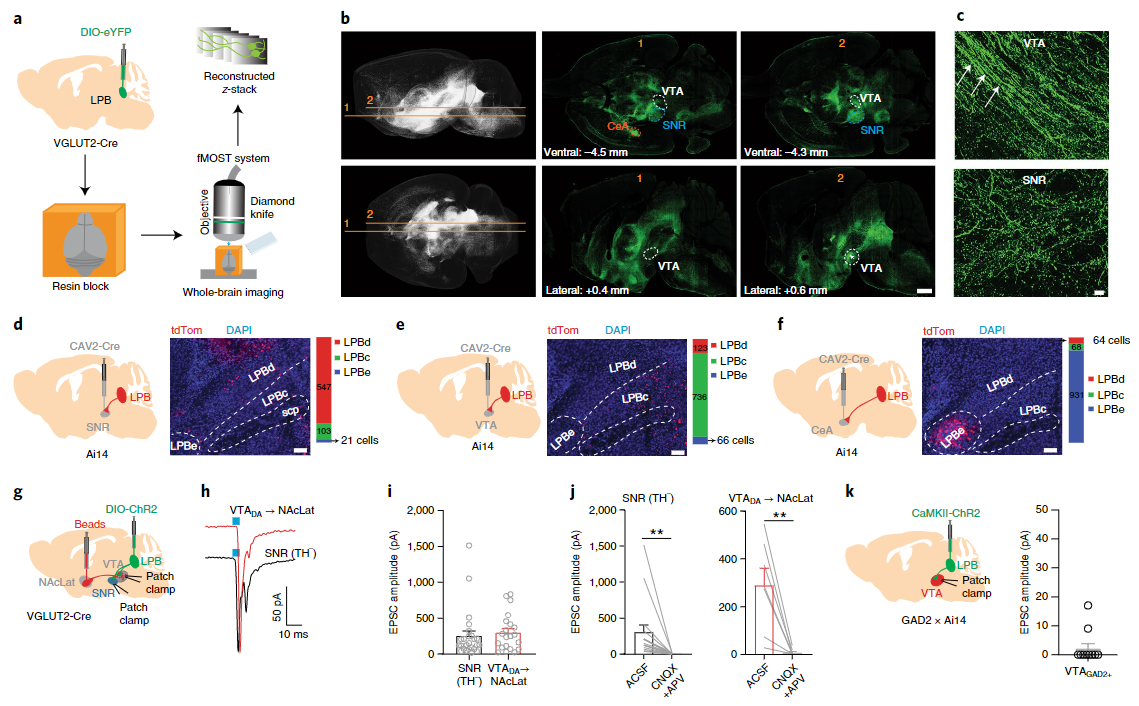
图1 臂旁核投射向中脑的功能神经解剖学结果
接下来,作者使用离体脑片膜片钳记录技术继续研究LPB向中脑的功能突触连接。VTA中包含多种不同类型的神经元,其中投射向伏隔核的多巴胺能神经元被认为与奖赏、动机行为相关有着密切的关系。那么,与LPB存在投射的VTA神经元究竟属于哪种类型呢?为了研究这个问题,作者在LPB的谷氨酸能神经元中表达了光敏感通道ChR2。离体脑片记录结果显示,当光刺激激活LPB投向VTA的神经纤维时,VTA中一群投向伏隔核的多巴胺神经元被记录到了明显的兴奋性突触后电位(图1g和h);而不同的是,在VTA中只有少量GABA能神经元表现出对光刺激的反应(图1k)。这意味着LPB直接向VTA的投射兴奋而不是抑制了VTA多巴胺神经元,与之前研究报道的疼痛会抑制VTA多巴胺神经元活动的结论刚好相反。与此同时,激活LPB投向SNR的纤维也会导致SNR中的GABA能神经元产生EPSCs(图1h)。
以上实验结果不得不令人深思,既然LPB向VTA的直接投射对VTA的多巴胺神经元起到的是兴奋作用,那么必然存在另外一条环路痛信号转化为对VTA多巴胺神经元的抑制信号。结合前面的实验结果,这条环路可能就是LPB投向SNR的环路。因此在后续的实验中,作者将目光转移到了这条通路的功能上。
作者首先检验了投向SNR的LPB神经元(为了简明,我们统一将其记作LPB→SNR神经元,对于其他环路也采取相同的记录规则)是否接受来自脊髓上行的疼痛信号。结合顺向和逆向示踪手段,研究者发现脊髓背角神经元投向LPB的纤维末梢与LPB→SNR神经元存在空间上的重叠(图2b)。膜片钳记录进一步发现光刺激激活脊髓背角投向LPB的纤维可以诱发LPB→SNR神经元产生突触后电位(图2d)。这些结果表明由脊髓背角上行的伤害感受性信号会与投射向SNR的LPB神经元产生连接。
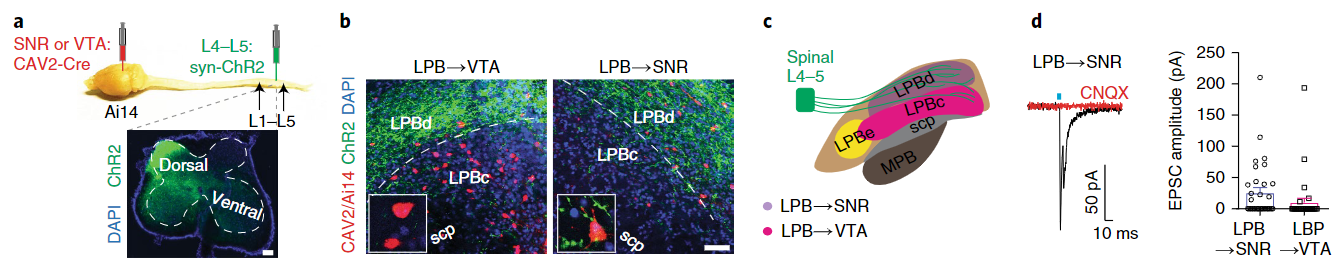
图2 脊髓背角神经元投射向LPB→SNR神经元
通过以上实验,作者成功鉴定了脊髓-LPB-SNR这一连接通路。接下来,作者检验该通路能否能够传输伤害感受性信号。为了检验这一问题,作者分别采用了光纤钙成像记录以及在体电生理记录结合光标记(Opto-tagging)手段对LPB→SNR神经元群体和个体的活动进行了记录。结果表明大部分LPB→SNR神经元可以被机械、电、热等多种伤害性刺激激活(图3)。而大约半数左右接受LPB投射的SNR神经元同样可以被伤害性刺激所激活(图4)。以上发现提示来自脊髓的伤害感受性信号可以通过LPB被传递至SNR。
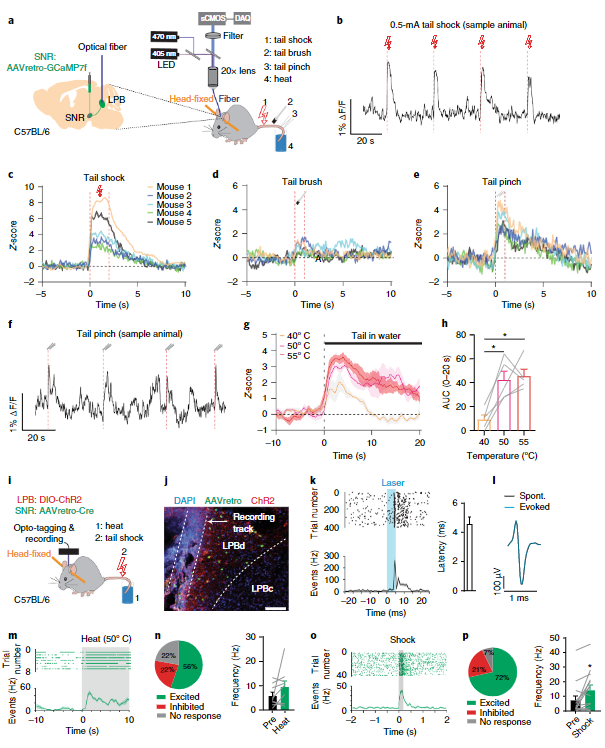
图3 LPB→SNR神经元可以对多种疼痛刺激做出反应

图4 接受LPB投射的SNR神经元可以被伤害性刺激激活
以上研究提示LPB→SNR环路与疼痛存在相关性,那么如果我们特异性抑制LPB向SNR投射通路的活动是否能够改变动物的疼痛表型呢?为了验证这一猜想,作者在双侧LPB表达抑制性的光蛋白NpHR,并将光纤埋置在SNR。在两种经典的疼痛模型(福尔马林测试是典型的伤害感受性疼痛模型;坐骨神经分枝选择性损伤SNL是典型的神经病理性疼痛模型)中,抑制LPB投射向SNR的通路均可以部分阻止动物的疼痛反应(图5a-j)。而场景偏好实验则显示出光刺激抑制LPB投向SNR的通路使得动物形成了疼痛缓解的记忆(图5k-m)。综上,光遗传操纵结合行为学实验表明,LPB→SNR通路在调控疼痛感受方面扮演了重要的角色。
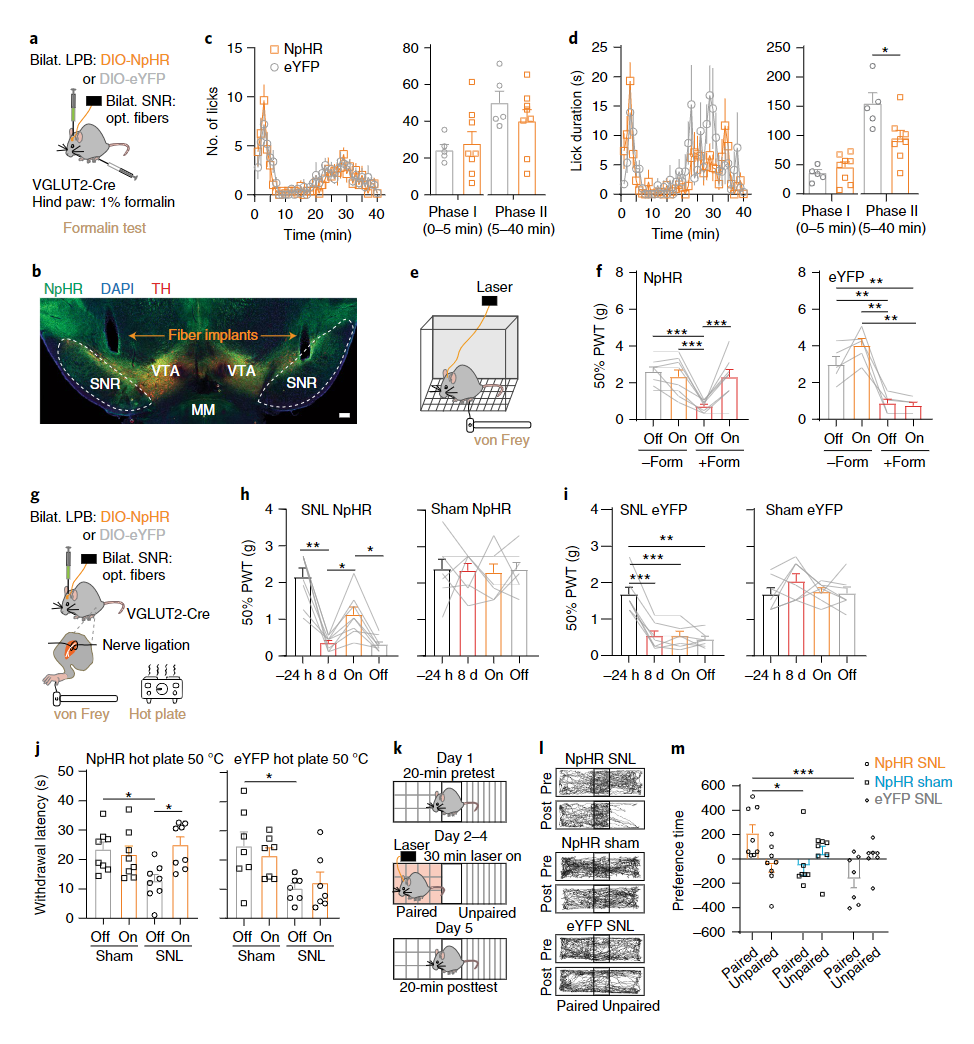
图5 抑制LPB→SNR通路可以减少动物对疼痛的行为反应
在确定LPB→SNR通路与疼痛存在密切联系后,接下来作者又将目光投向了该通路是如何调控VTA多巴胺神经元的活动这一问题上,这也是本文最重要的问题之一。为了探索该问题,作者再次回到“结构-记录-操纵”这一循环当中。具体而言,首先利用神经示踪和离体膜片钳记录技术作者发现SNR和VTA之间存在直接和间接两条不同的连接通路。其中直接通路从SNR出发直接投向VTA,这一通路的激活可以直接抑制VTA的活动(图6a-c)。而间接通路则从SNR投回LPB,而这群接受SNR投射的LPB神经元也同时投射向VTA多巴胺神经元(图6e)。SNR的活动可以抑制这群投向VTA的LPB神经元的活动,从而解除后者对VTA多巴胺神经元的兴奋作用。两条通路结构不同,但是均表现出对VTA多巴胺神经元活动的抑制作用。
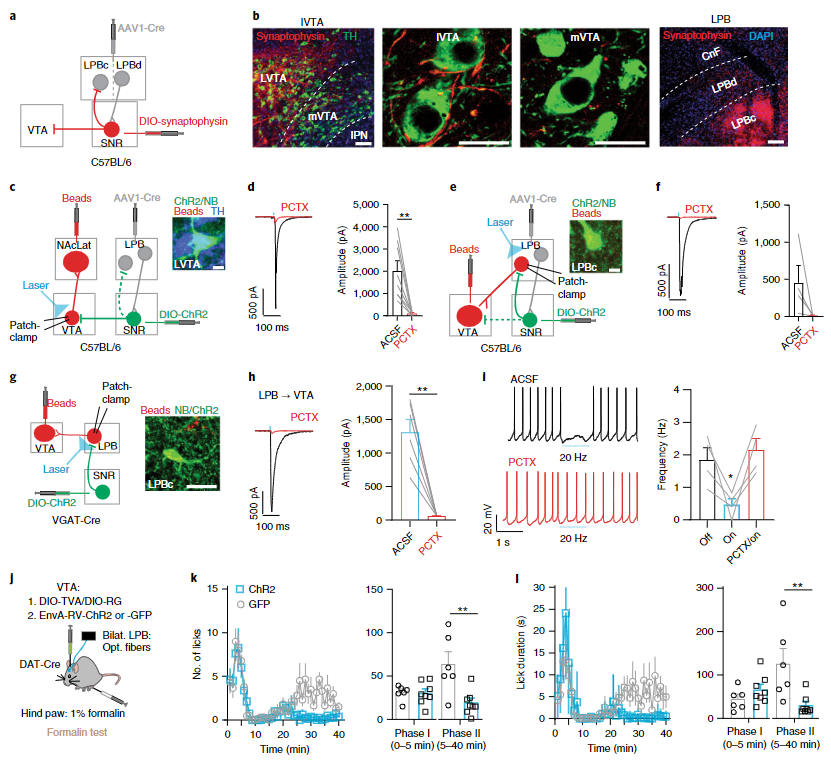
图6 接受LPB投射的SNR神经元通过直接和间接两条通路支配VTA多巴胺神经元
在解析结构之后,作者继续分析SNR对VTA多巴胺神经元的两条投射通路在疼痛中的作用。作者首先利用伪狂犬病毒逆向跨突触投射的特性在直接投向VTA的SNR神经元中特异性表达ChR2(图6j)。在福尔马林诱导的疼痛模型中,激活直接通路神经元可以显著改善动物的疼痛感受表型(图6k和i),提示直接通路可以改变动物对疼痛的反应行为。
同时,结合光遗传刺激和在体光纤钙成像记录,作者发现激活SNR向LPB的投射可以降低VTA向伏隔核的多巴胺释放(图7d),这一发现提示间接通路的活动对VTA多巴胺神经元的活动同样可以起到调控作用。
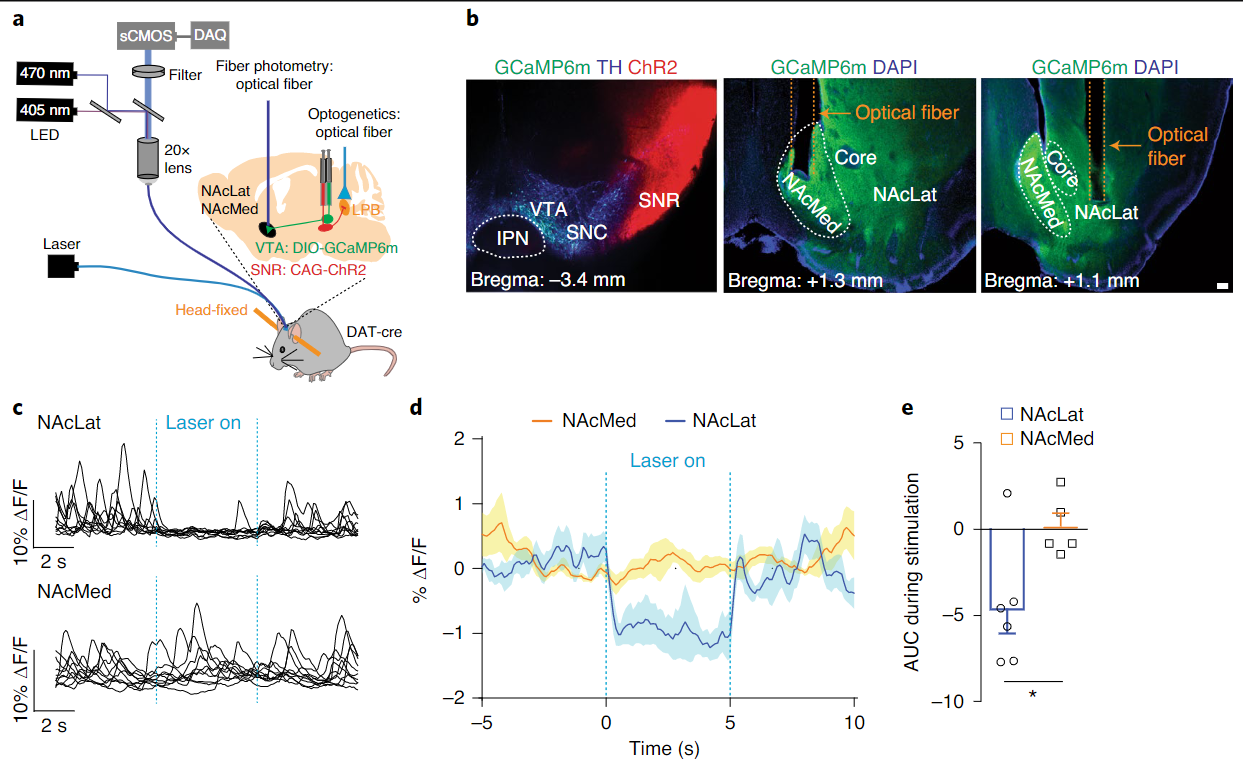
图7 SNR→LPB活动可以影响VTA多巴胺释放
至此,通过两轮“结构-记录-操纵”的循环,作者有力地证明了LPB→SNR环路接受来自脊髓的疼痛信号并参与疼痛感受行为的调控。同时,该通路还通过直接和间接两条途径将伤害感受性信号传递至VTA的多巴胺神经元,从而达到调控后者活动的目的。在惊叹于本文工作量的同时,本文严谨的逻辑顺序和极为丰富的实验手段的应用也为我们设计功能神经环路研究提供了良好的参考作用。和元生物推出了福尔马林测试、SNI或CCI等疼痛模型动物构建及Von Frey痛阈检测等服务助力疼痛领域研究,年中促销更是免费赠送假损伤对照动物,欢迎前来咨询。

