2019年,地球村遭遇了新冠病毒的攻击,新冠大魔王派出了Alpha、Gamma、Delta、Lambda、Omicron等毒株作为先锋,试图通过感染的方式占领地球村。人类奋起反抗,利用新冠疫苗和科学的防疫手段保卫着自己的家园。然而最近新冠大魔王通过几种相关病毒共同感染同一个细胞的方式,将多个突变株重组整合,形成了毒性更强的XD(Delta和Omicron BA.1的重组体)、XE(Omicron BA.1和BA.2的重组体)、XF(Delta和Omicron BA.1的重组体)等多种重组病毒。人类的家园保卫战已经打响,那么如何在击退新冠大魔王的同时,尽量减少损失呢?

这个时候,类器官兵团作为研究病毒-宿主相互作用的“替身”上场了,这个兵团由肺、脑、心脏、肾等多种类器官模型组成,其结构不仅保留了与体内器官高度相似的组织学、遗传学特点,同时形成的组织有干细胞增殖与分化潜能。这些类器官主要用于代替人类进行体外模拟病毒感染实验,进而对感染的靶点、候选药物的筛选进行研究。
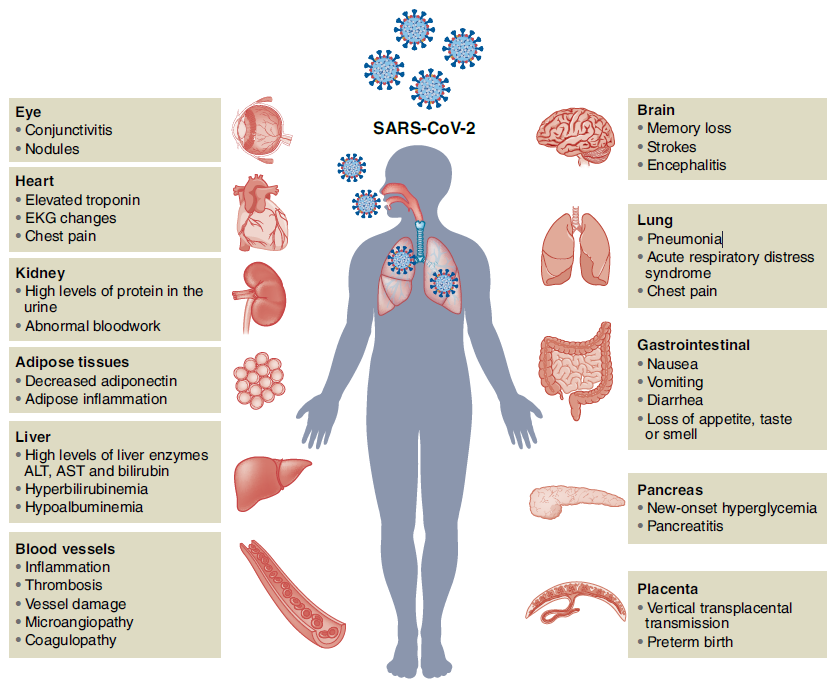
图1. SARS-CoV-2感染的人体器官[1]
肺类器官
新型冠状病毒感染主要涉及呼吸系统,通过唾液飞沫从一个人传播到另一个人。在新冠肺炎阳性的病例中,87%患者的肺组织呈现典型的弥漫性肺泡损伤特征。
肺是一个具有高度分支的器官,传统的肺细胞系不能够准确反映出肺在体内的情况,而人类肺类器官包含各种细胞类型,这些细胞在空间组织和功能上类似于胎儿的肺组织,Paola Spitalieri等人[2]通过在体外模拟人类胎儿肺器官发育成熟的过程,成功地制备出了可长期培养的人肺类器官(hLORGs),目前正在应用该模型进行细胞嗜性、宿主细胞反应、影响病毒易感性的遗传变异、新型候选药物等多项研究。
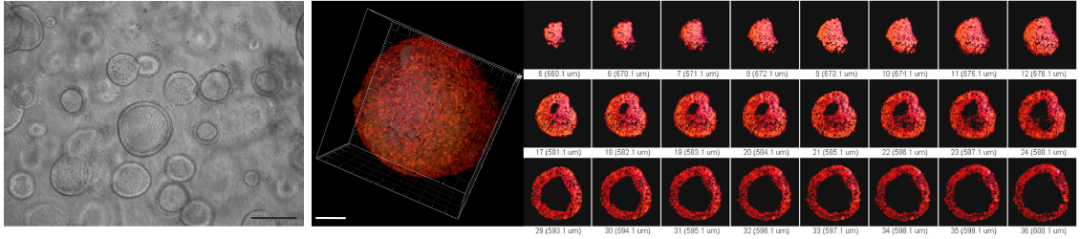
图2. 体外培养用于 SARS-CoV-2感染的人肺类器官模型(hLORGs)[2]
脑类器官
大量病例报告表明,新冠肺炎可以表现出暂时或完全丧失嗅觉功能,并且已经在患者脑样本中检测到病毒RNA,这些报告表明新型冠状病毒有嗜神经性特征。目前脑类器官正在新冠感染机理研究中大放异彩。Eric Song等人[3]在2020年发现,SARS-CoV-2感染人脑类器官后,能够观察到明显的感染现象,并且伴随着感染神经元和邻近神经元的代谢变化;同时证明了阻断ACE2抗体后可以预防神经元感染。Jacob等人[4]发现了在感染新冠病毒的脑类器官模型中,炎症信号相关基因的表达上调;Wang等人[5]利用脑类器官模型确定了新冠肺炎的一个重要致病因子:ApoE4。
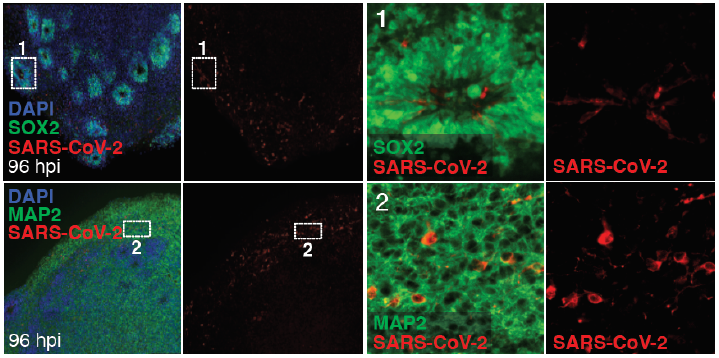
图3. SARS-CoV-2感染人脑类器官后,随着时间延长,SARS-CoV-2阳性细胞增多[3]。
消化道类器官
新冠肺炎患者还表现出各种胃肠道症状,包括腹泻、恶心、呕吐、厌食和腹痛。单细胞分析表明,ACE2和TMPRSS2在回肠和结肠中均有表达,而在小肠中ACE2的表达量最高。Clevers小组[6]在人类AdSC衍生的肠类器官样本中观察到了被SARS-CoV-2感染的情况,再次强调了类器官能够在体外快速、高效地重现病毒感染过程。Mithal等人[7]找出了人类肠道类器官可以被病毒感染及激活干扰素相关的基因,包括BST2、OASL、MX1、IFITM1和IRF7。这些基因的发现为后续的药物研发提供了有力的依据和研究的方向。
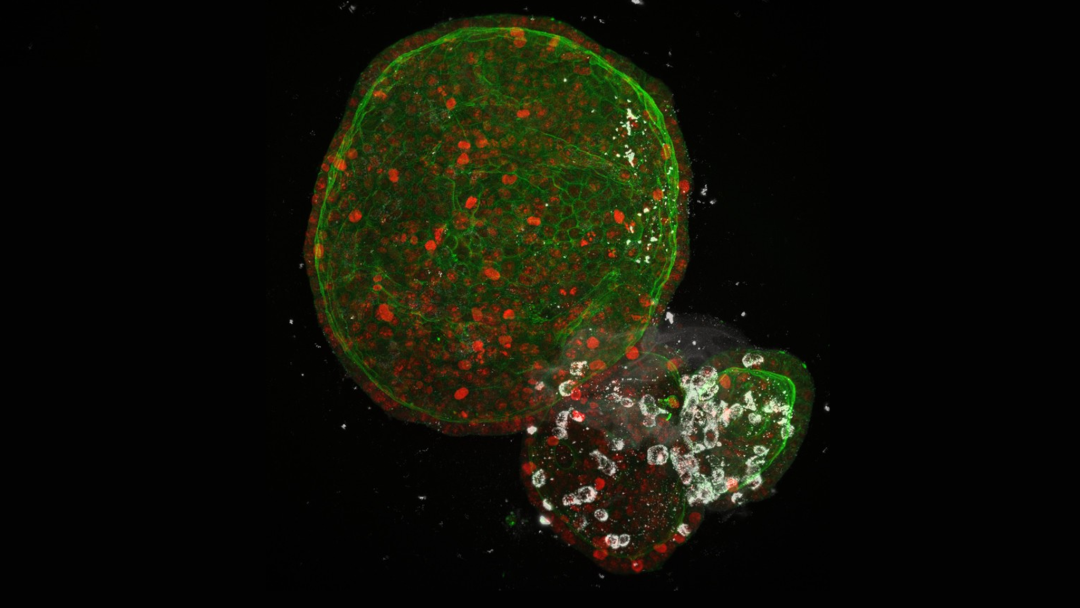
图4. 感染SARS-CoV-2的人体肠道类器官(白色)(图片来源: Joep Beumer/Clevers group/Hubrecht Institute)
其它类器官
新冠肺炎研究中也会使用其它相关类器官,包括肾脏、视网膜、血管和肝脏类器官。
在对新冠肺炎的第一批研究中,Monteil 等人[8]证明了新型冠状病毒可以直接与血管和肾脏类器官相互作用,并且这种相互作用可以通过用临床级可溶性ACE2治疗来阻断。Yang等人[9] 已经证明人肝脏类器官和胆管类器官也易受新型冠状病毒感染,并且趋化因子的诱导模式与在患者样本中发现的模式相似。
类器官模型助力新冠药物开发
新冠肺炎是一种新的疾病,致病机制仍需要进一步研究,开发有效药物仍然是科研工作重心。
研究人员通过类器官模型,已找到了多个与新冠感染相关的蛋白,对它们进行了结构功能性研究、药物设计和筛选。药品研发主要从以下四个方面进行:一是抑制病毒进入细胞,如通过中和抗体对病毒表面的刺突糖蛋白进行封闭;二是抑制病毒蛋白酶活性,如PL、3CL蛋白酶抑制剂,阻止病毒的转录、翻译;三是通过抑制与病毒复制相关的RNA聚合酶而具有抗病毒活性,如瑞德西韦(Remdesivir)就是抑制病毒RNA复制、转录的一种核苷酸类似物;四是抑制病毒融合、包装、转运,如弗林蛋白酶(Furin)抑制剂、跨膜丝氨酸蛋白酶(TMPRSS2)抑制剂。
目前,治疗新冠肺炎的药物基本采用“老药新用”策略,在安全的基础上,根据药物作用机理,合理推测疾病适应症。

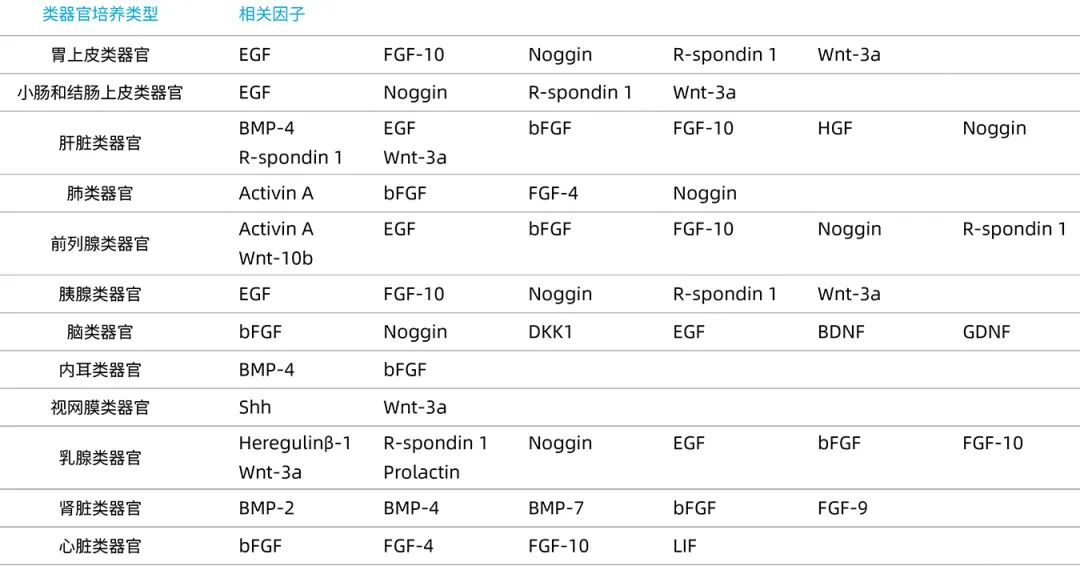
类器官培养系统
类器官的形成需要单细胞或小细胞群增殖并重组,成为复杂的、有组织的细胞团,从而模拟特定器官的一些结构和功能特征。虽然干细胞具有分化的特性,但是怎样将各个细胞分化成为理想的细胞类型呢?答案就是细胞因子。不同种类的类器官培养过程中所需的细胞因子略有差异,通过添加促进或抑制特定信号通路的因子,将培养物导向感兴趣的细胞谱系。例如:肺类器官的培养需要添加Activin A、FGF basic、FGF-4、Noggin;而前列腺类器官则需要添加EGF、Activin A、FGF basic、FGF-10、Noggin。
近岸蛋白自主研发生产的低内毒素Activin A、EGF、FGF basic、R-Spondin 1、Noggin、Wnt3a等细胞因子,内毒素低至<10EU/mg,具有高活性、高纯度、高批间一致性,为类器官培养设计,已获得市场认可,让您研究放心!
常见类器官培养相关细胞因子
推荐产品
|
货号 |
产品名称 |
参考文献
1. HAN, Yuling, et al. Human organoid models to study SARS-CoV-2 infection. Nature Methods, 2022, 1-11.
2. SPITALIERI, Paola, et al. Two Different Therapeutic Approaches for SARS-CoV-2 in hiPSCs-Derived Lung Organoids. Cells, 2022, 11.7: 1235.
3. SONG, Eric, et al. Neuroinvasive potential of SARS-CoV-2 revealed in a human brain organoid model. 2020.
4. JACOB, Fadi, et al. Human pluripotent stem cell-derived neural cells and brain organoids reveal SARS-CoV-2 neurotropism predominates in choroid plexus epithelium. Cell stem cell, 2020, 27.6: 937-950. e9.
5. WANG, Lu, et al. A human three-dimensional neural-perivascular ‘assembloid’promotes astrocytic development and enables modeling of SARS-CoV-2 neuropathology. Nature medicine, 2021, 27.9: 1600-1606.
6. LAMERS, Mart M., et al. SARS-CoV-2 productively infects human gut enterocytes. Science, 2020, 369.6499: 50-54.
7. MITHAL, Aditya, et al. Human pluripotent stem cell-derived intestinal organoids model SARS-CoV-2 infection revealing a common epithelial inflammatory response. Stem cell reports, 2021, 16.4: 940-953.
8. Monteil V,Kwon H,Prado P,et al. Inhibition of SARS-CoV-2 Infections in Engineered Human Tissues Using Clinical-Grade Soluble Human ACE2[J].Cell,2020,S0092-8674(20)30399-8.
9. YANG, Liuliu, et al. A human pluripotent stem cell-based platform to study SARS-CoV-2 tropism and model virus infection in human cells and organoids. Cell stem cell, 2020, 27.1: 125-136. e7.
苏州近岸蛋白质科技股份有限公司,是一家专注于重组蛋白应用解决方案的高新技术企业,主营业务为靶点及细胞因子类蛋白、重组抗体、酶及试剂的研发、生产和销售,并提供相关技术服务。公司定位为医疗健康与生命科学领域原料与技术解决方案的上游供应商,致力于为下游客户提供及时、稳定、优质的产品及服务,助力全球生物医药企业和研究机构的技术与产品创新升级。
