暨南大学吴建国教授/潘攀研究团队,在Nature子刊《Nature Communication》发表题为“SARS-CoV-2 N protein promotes NLRP3 inflammasome activation to induce hyperinflammation”(DOI: 10.1038/s41467-021-25015-6 ),该研究展示了SARS-CoV-2 N蛋白通过促进NLRP3炎症小体激活诱导高炎症反应;N蛋白促进促炎因子的成熟,并诱发细胞和小鼠的促炎反应;N蛋白直接与NLRP3蛋白相互作用,促进NLRP3与ASC结合,促进NLRP3炎症小体组装;N蛋白加重脓毒症和急性炎症小鼠模型中肺损伤,加速死亡,促进小鼠IL-1β和IL-6激活。
SARS-CoV-2 N蛋白诱导细胞和小鼠促炎反应
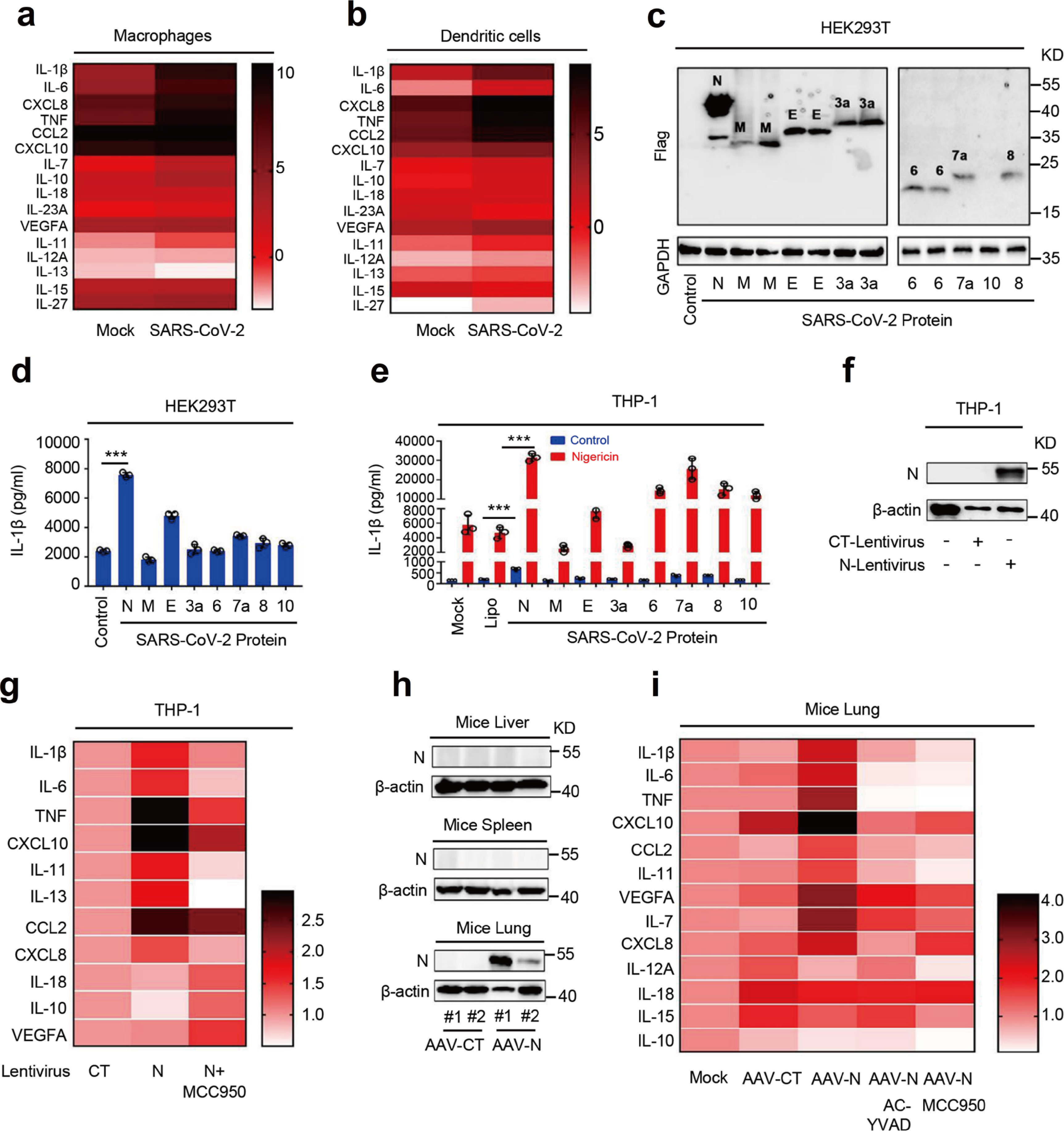
首先,SARS-CoV-2感染巨噬细胞和树突细胞(DCs)后多种促炎因子趋化因子及配体均有不同程度增加;研究人员对SARS-CoV-2蛋白对IL-1β释放的影响进行研究,WB结果显示N蛋白在HEK293T细胞表达最高(Fig.1c),ELISA结果显示N蛋白表达的HEK293T-NLRP3炎症小体体系IL-1β最高(Fig.1d),SARS-CoV-2 N蛋白加强Nigericin诱导的IL-1β分泌(Fig.1e)。因此SARS-CoV-2 N蛋白在IL-1β成熟及分泌中发挥重要作用。N蛋白介导THP-1包含IL-1β在内的炎症因子表达, MCC950(NLRP3特异性抑制剂)可以抑制上述炎症因子的表达(Fig.1g)。利用AAVlung-N在小鼠肺中表达N蛋白,AAVlung-N可以显著增加IL-1β,IL-6,TNF,CXLC10,CCL2,IL-11,IL-7和CXCL8的mRNA表达,另外Ac-YVAD-cmk(Caspase-1抑制剂,阻断IL-1β成熟)和MCC950对AAVlung-N诱导的上述因子表达均有不同程度的恢复作用(Fig.1h&1i)。因此,研究人员推测N蛋白促进NLRP3炎性小体激活,从而诱导成熟IL-1β分泌,进而在诱导炎症因子和细胞因子中发挥关键作用。结果表明,SARS-CoV-2 N蛋白在诱导促炎因子中发挥关键作用,N蛋白可能参与调节NLRP3炎症小体的激活。
Fig. 1 SARS-CoV-2 N蛋白诱导炎症反应
SARS-CoV-2 N蛋白诱导IL-1β成熟和IL-6产生
考虑到激动剂对促炎因子表达的主导作用,接下来研究人员对SARS-CoV-2 N蛋白在IL-1β成熟中的作用进行研究。研究发现N蛋白可以促进IL-1β的分泌、IL-1β cleavage和Caspase-1成熟且呈现剂量依赖,LPS+ATP和LPS+Nigericin均可诱导IL-1β的分泌和cleavage,N蛋白可以进一步促进IL-1β的分泌和cleavage(Fig.2a&2b)。LPS+ATP和LPS+Nigericin可以促进THP-1细胞IL-18和IL-6,N蛋白仅能促进IL-6的分泌,不能促进IL-18的分泌,MCC950抑制IL-1β和IL-6分泌;LPS+ATP或LPS+Nigericin同样可以促进BMDM细胞的IL-1β和IL-6的分泌,并且在NLRP3-/-小鼠BMDM中LPS+ATP或LPS+Nigericin对IL-6和IL-1β分泌并无显著促进作用(Fig.2c-2j)。综上所述,N蛋白诱导IL-1β的成熟和IL-6的产生,并揭示NLRP3是N诱导IL-1β分泌和IL-6产生所必需的,因此N蛋白可能在NLRP3炎症小体的激活中发挥重要作用。
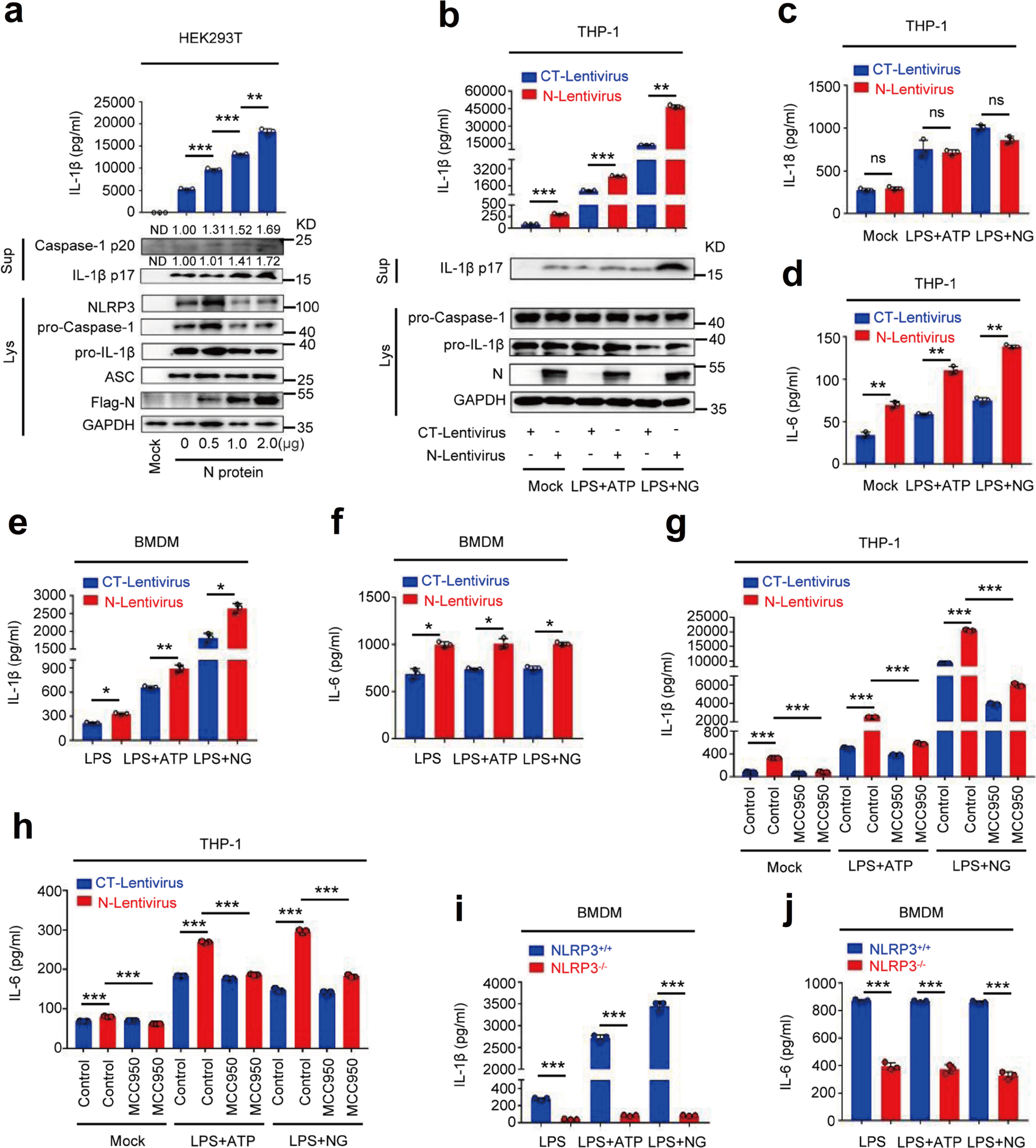
Fig.2 N蛋白诱导IL-1β成熟和IL-6生成
SARS-CoV-2 N蛋白与NLRP3交互作用
接下来研究者对SARS-CoV-2 N蛋白在NLRP3炎症小体调控中的作用进行研究。CO-IP结果显示,N蛋白仅与NLRP3蛋白相互作用,且His-N蛋白可以直接与NLRP3蛋白结合(Fig.3a-3e),N蛋白和NLRP3共定位于细胞质中,N蛋白与ASC无交互作用(Fig.3f-3i)。所以,N蛋白特异性与NLRP3蛋白相互作用,调节NLRP3炎症小体分泌。

Fig.3 SARS-CoV-2 N蛋白与NLRP3蛋白相互作用
N蛋白参与NLRP3炎症小体激活
通过评估N蛋白的截短突变体N1-N8,鉴定参与NLRP3相互作用的SARS-CoV-2 N蛋白序列。结果表明,NLRP3蛋白与N1、N5、N6和N7相互作用,并且IL-1β分泌、IL-1β cleavage和Caspase-1 p20 maturation 亦受N蛋白N1、N5、N6和N7影响(Fig.4a-4e),因此,N蛋白260aa-340aa截短体参与了与NLRP3的相互作用并激活NLRP3炎症小体。
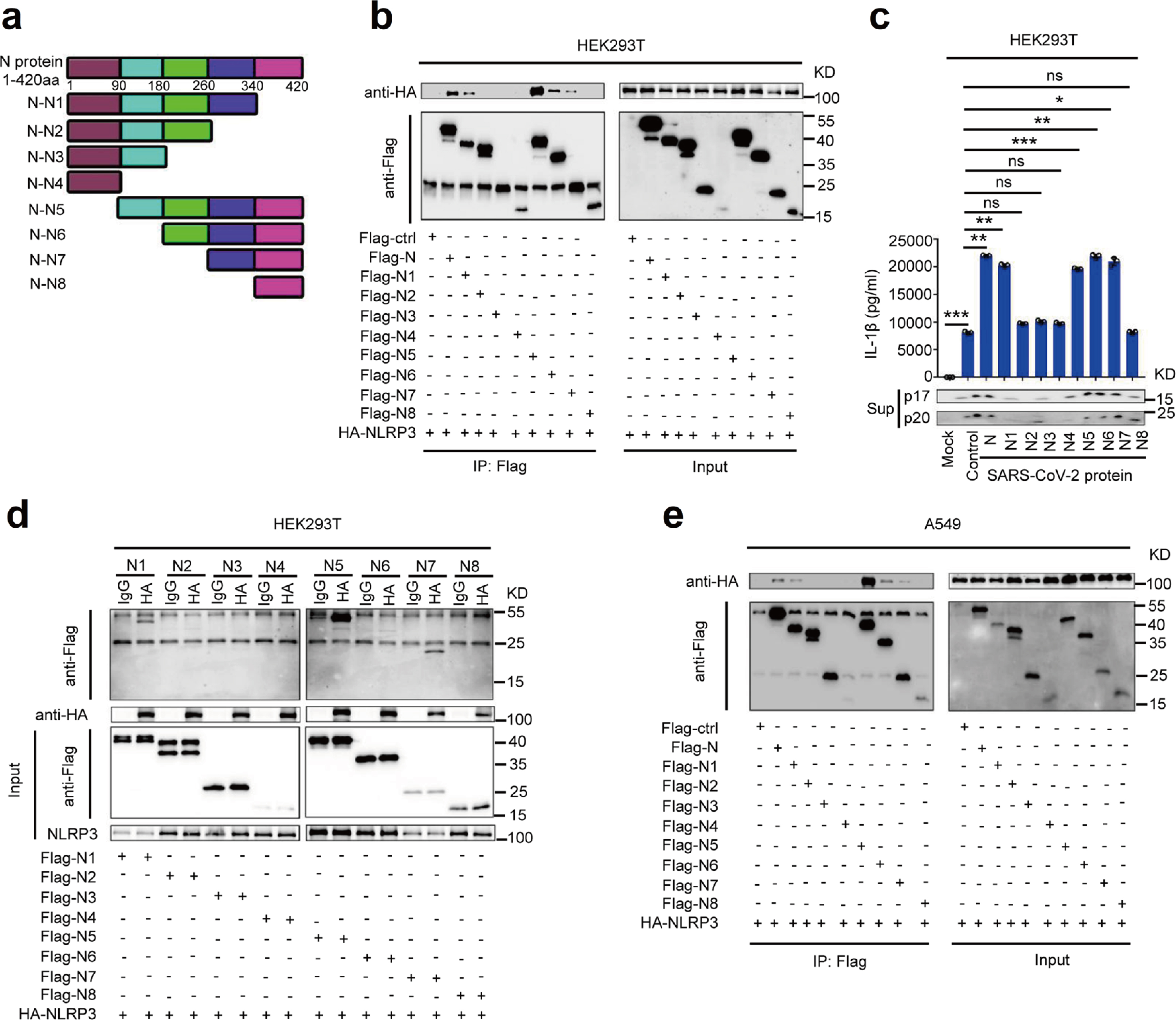
Fig.4 N蛋白截短体参与NLRP3炎症小体激活
N蛋白促进NLRP3与ASC的相互作用
接下来研究人员对N蛋白在调节NLRP3炎症小体成分中的作用进行研究。结果显示,N蛋白对NLRP3、Caspase-1和ASC的蛋白水平没有影响,然而NLRP3存在时N和ASC可以相互免疫沉淀(Fig.5a-5e)。因此,该结果提示N蛋白、NLRP3和ASC三个蛋白可能形成一个复杂的N-NLRP3-ASC复合物。N蛋白增强NLRP3与ASC的相互作用在HEK293T和A549细胞并呈剂量依赖(Fig.5f-5g)。同样,在PMA-differentiated THP-1-N细胞中,Nigericin促进 N蛋白在NLRP3存在的情况下与内源性ASC相互作用(Fig.5h)。因此,SARS-CoV-2 N 促进NLRP3与ASC的相互作用。
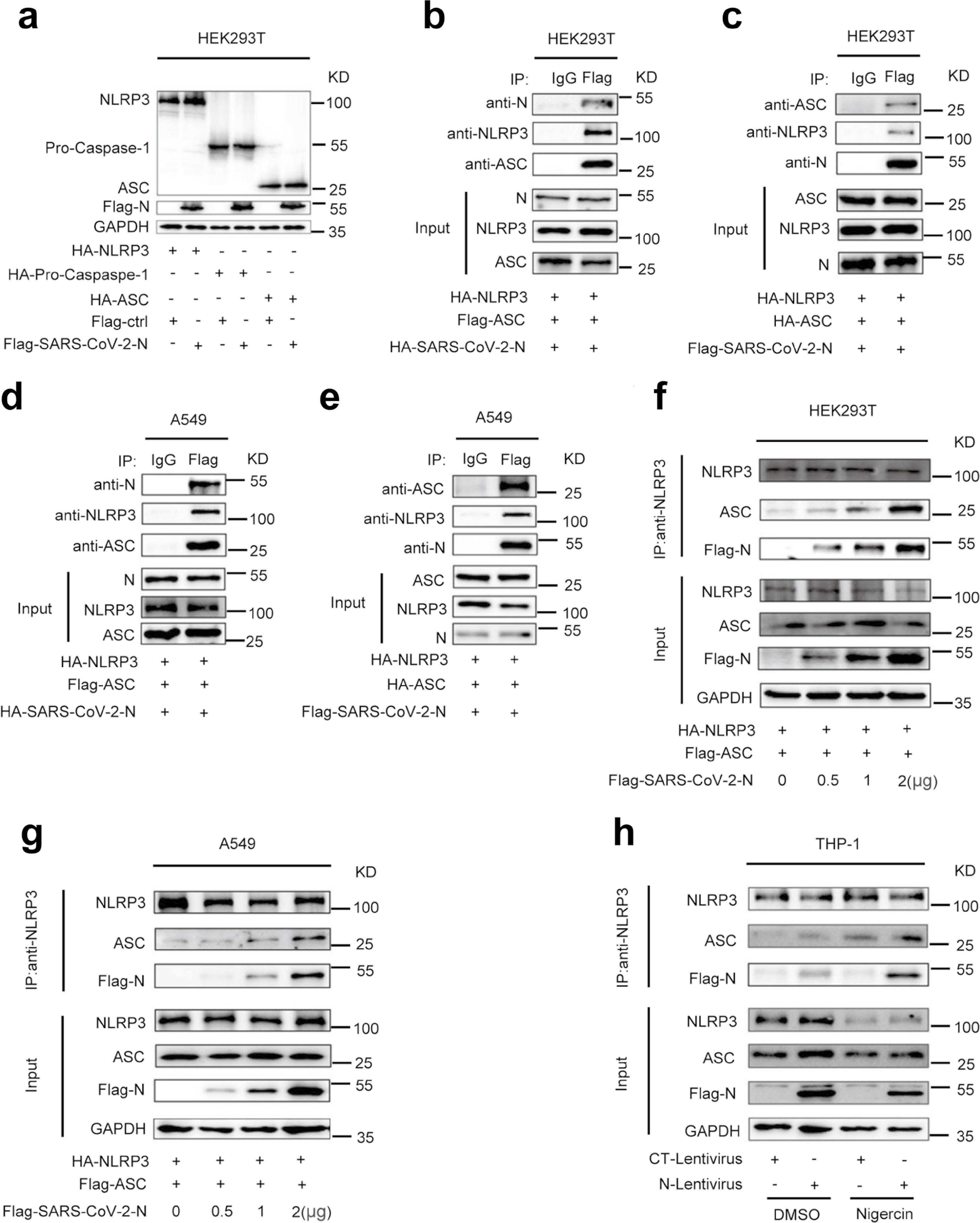
Fig.5 N蛋白促进NLRP3与ASC的相互作用
SARS-CoV-2 N蛋白促进NLRP3炎性小体组成
对NLRP3在细胞质中进行定位,NLRP3呈弥散状分布于细胞质,而SARS-CoV-2 N蛋白存在时,NLRP3呈聚集的斑点状(Fig.6a),SARS-CoV-2 3a蛋白与NLRP3共定位,但未能形成斑点状聚集。SARS-CoV-2 N2和N8 截短体,同时分布在细胞核和细胞质中且不能与NLRP3和共定位,NLRP3在HEK293T细胞的细胞质中未形成斑点状聚集(Fig.6b&6c)。THP-1细胞中NLRP3分布与HEK293T细胞和A549细胞几乎一致,且N蛋白存在时,内源性NLRP3蛋白在细胞质中聚集形成斑点(Fig.6d&6e)。因此,SARS-CoV-2 N蛋白可能促进NLRP3炎症小体复合体的形成。
THP-1细胞和BMDM细胞中,Nigericin刺激内源性ASC蛋白oligomerization,并且N蛋白可以促进这一反应(Fig.6f&6g)。此外,HEK293T-NLRP3细胞分别转染编码SARS-CoV-2-N蛋白及其截短突变体,ASC oligomerization被N1、N5、N6和N7蛋白激活,而不受N2、N3、N4、N8蛋白影响(Fig.6h)。所以,N蛋白序列260aa-340aa与NLRP3相互作用,促进ASC oligomerization。
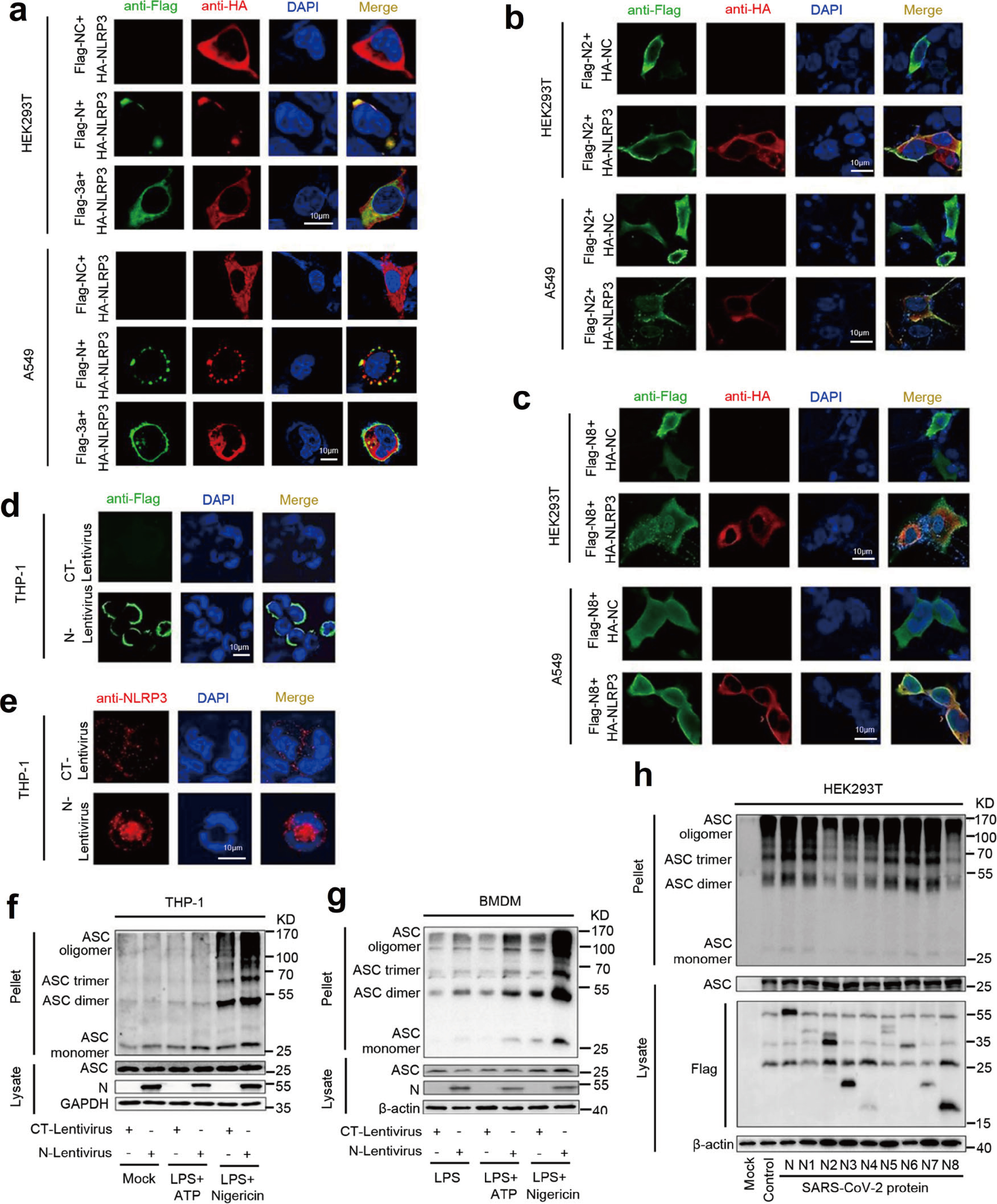
Fig.6 N蛋白促进NLRP3聚集和ASC oligomerization
此外,研究人员还探究了N蛋白对NLRP3炎症小体复合物组装的影响。将HEK293T细胞或A549细胞共转染不同质粒,GFP同时分布于细胞核和细胞质中,NLRP3弥散状分布于细胞质(Fig.7a&7b(a-e));N蛋白和NLRP3表达时,NLRP3与N蛋白共定位,呈斑点状(Fig.7a&7b(f-j));GFP和ASC表达时,GFP与ASC同时分布于细胞核和细胞质中,并形成小的环状结构(Fig.7a&7b(k-o));N蛋白和ASC表达时,N蛋白和ASC无法共定位(Fig.7a&7b(p-t));GFP、ASC和NLRP3同时表达时,NLRP3和ASC共定位于细胞质并形成环状结构(Fig.7a&7b(u-y));值得注意的是,当N蛋白、ASC和NLRP3同时表达时,3种蛋白共定位形成球状结构(Fig.7a&7b(z-d));当3a、ASC和NLRP3同时存在时,3种蛋白共定位未能形成球状结构(Fig.7a&7b(ae-ai))。综上所述,SARS-CoV-2 N蛋白促进NLRP3炎性小体复合物组装,而非SARS-CoV-2 3a蛋白。
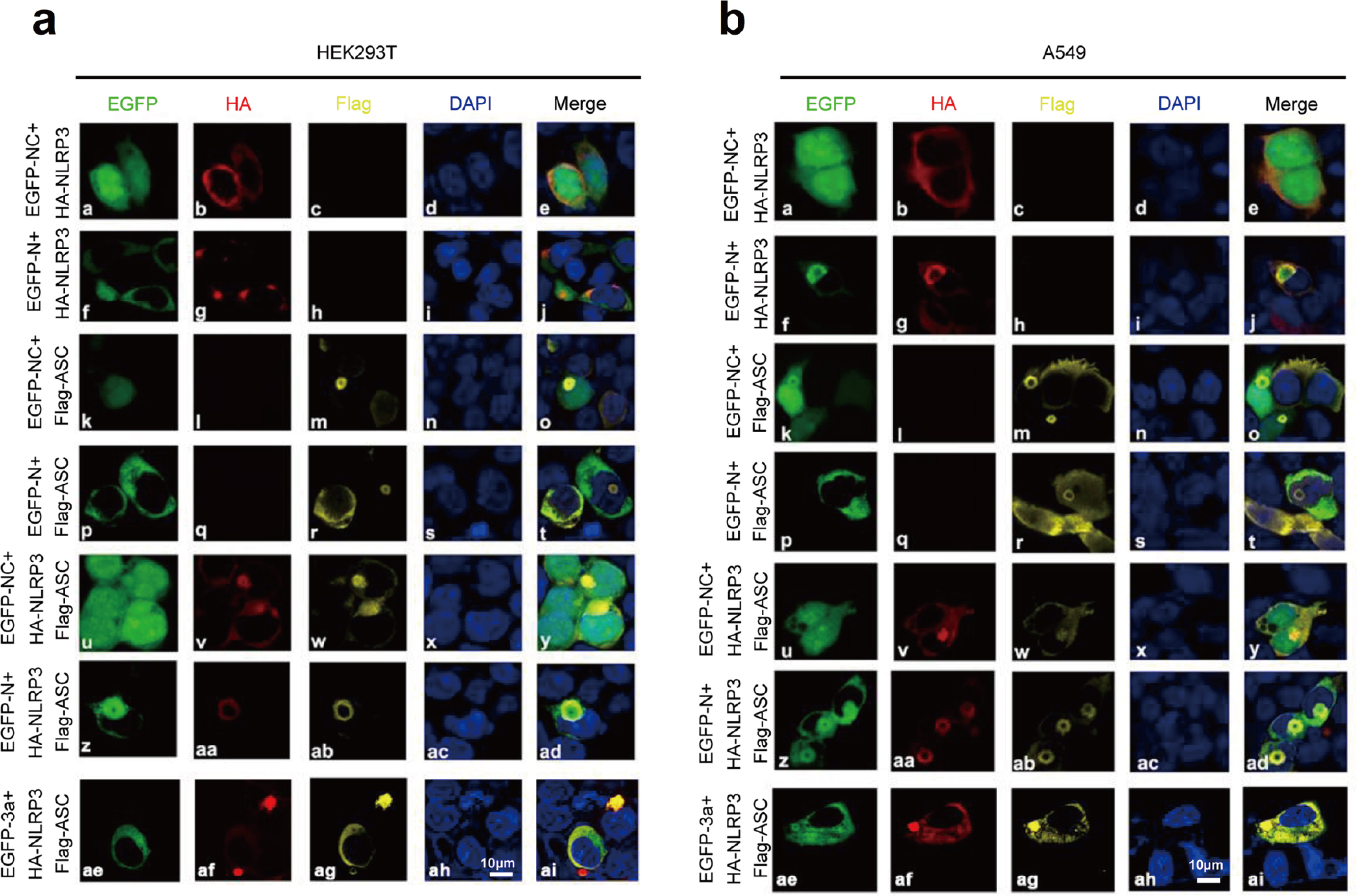
Fig.7 N蛋白促进NLRP3炎性小体组装
N蛋白激活NLRP3炎症小体诱导小鼠肺损伤
接下来,研究人员对SARS-CoV-2 N蛋白在激活NLRP3炎症小体的生物学作用进行评价。通过在C57BL/6小鼠表达N蛋白,探究N蛋白在肺损伤中的作用。注射AAVlung-N的小鼠,血清中IL-1β和IL-6的水平明显高于对照组,且Ac-YVAD-cmk和MCC950均可抑制该反应(Fig.8a&8b),但AAVlung表达N蛋白并未影响血清中IL-18的表达(Fig.8c)。AAVlung感染的小鼠肺部免疫荧光结果显示,AAVlung-N小鼠肺部IL-1β和IL-6表达明显高于其他分组,Ac-YVAD-cmk和MCC950均可降低IL-1β和IL-6表达(Fig.8d&8e)。HE染色显示,携带AAVlung-N的小鼠肺部有明显的的炎症病变及组织损伤,Ac-YVAD-cmk和MCC950均可抑制肺组织的病变(Fig.8f)。这些结果表明NLRP3炎性小体是N蛋白诱导的小鼠肺损伤发生所必需的。

Fig.8 N蛋白激活NLRP3炎症小体诱导小鼠肺损伤
ELISA结果显示,AAVlung-N诱导NLRP3+/+小鼠IL-1β和IL-6的表达,在NLRP3-/-无明显影响,说明NLRP3在N蛋白介导的IL-1β和IL-6激活中不可或缺(Fig.9a&9b),对IL-18激活没有影响(Fig.9c)。并且携带AAVlung-N的NLRP3+/+小鼠肺组织免疫组化结果IL-1β和IL-6的表达明显高于NLRP3-/-小鼠(Fig.9d&9e)。HE病理染色同样显示携带AAVlung-N的NLRP3+/+小鼠肺部有明显的炎症病变及组织损伤(Fig.9f)。因此,N蛋白通过激活NLRP3炎症小体诱导小鼠全身炎症,引发肺损伤。
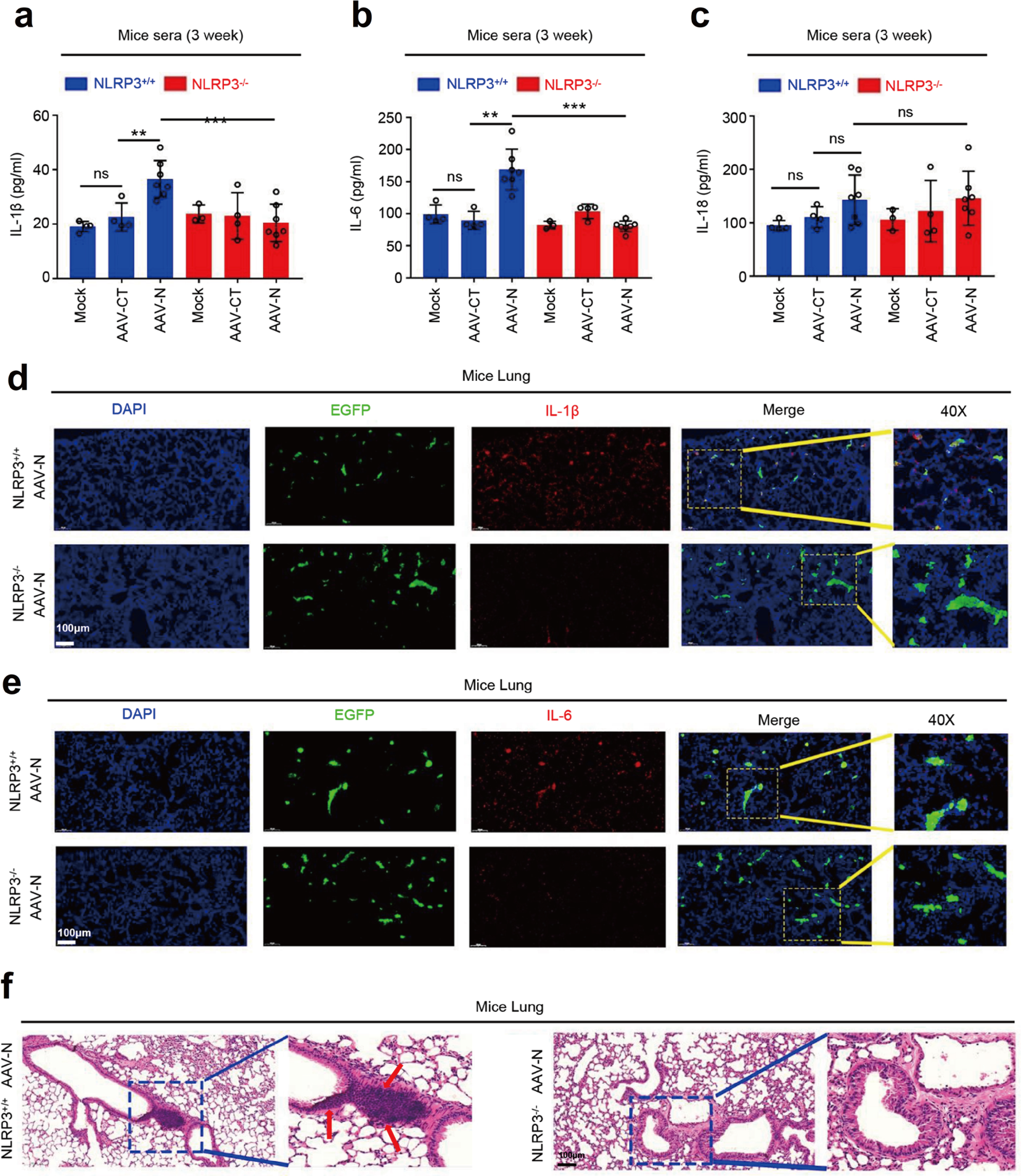
Fig.9 NLRP3在N蛋白诱导的肺损伤中发挥重要作用
综上所述,研究人员揭示了COVID-19的病理机制,其中SARS-CoV-2 N蛋白通过促进NLRP3炎症小体的激活从而促进炎症和肺部损伤。
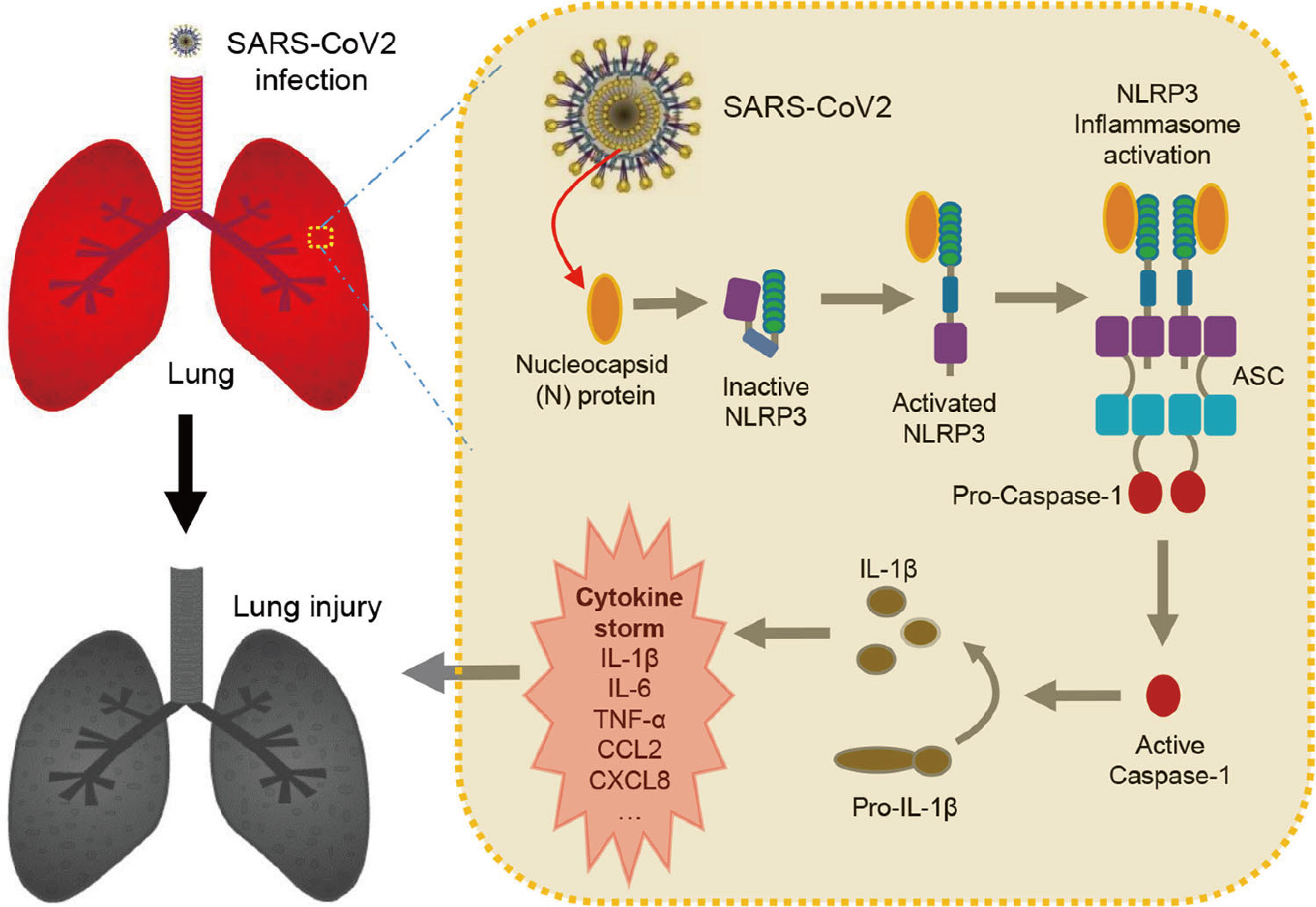
Fig.10 N蛋白通过激活NLRP3炎症小体诱导肺损伤模型
结论
在该研究中,研究人员通过分析GEO数据库(GSE155106)发现SARS-CoV-2感染巨噬细胞和DCs会促进大量细胞因子和趋化因子的表达。通过筛选,研究人员发现SARS-CoV-2 N蛋白通过激活NLRP3炎性小体,促进炎症因子的表达导致小鼠肺损伤,加重脓毒症模型小鼠的死亡。N蛋白直接与NLRP3作用,促进NLRP3炎性小体聚合,从而激活NLRP3炎性小体。综上所述,该研究结果证实SARS-CoV-2 N蛋白通过NLRP3炎症小体诱导肺损伤的新机制。