新生儿的器官经历了组织生长和功能成熟的过程,以适应其功能需求和环境刺激。肝脏是胚胎早期的造血器官,在成年后转变为以代谢功能为主,并伴有表观遗传修饰的广泛变化。尽管对于胚胎期细胞类型鉴定和肝脏器官发生的初始阶段有了一定了解,但对于出生后肝脏发育和功能成熟的调控知之甚少。
RNA修饰最近被认为是表观遗传学的新关注点,N6-methyladenosine(m6A)是真核生物mRNA上最常见的一种转录后修饰,介导了超过80%的RNA碱基甲基化。其中甲基化转移酶(methyltransferase,也叫Writers)是一类重要的催化酶,能够让mRNA上的碱基发生m6A甲基化修饰,而METTL3作为m6A甲基化转移酶的核心蛋白参与发挥重要功能。目前对于Mettl3在维持某些器官稳态中的作用进行了广泛的研究,然而Mettl3/m6A介导的表观转录组学机制在出生后肝脏发育中的确切作用仍然存在争议。
研究成果
2023年5月15日,山东大学基础医学院袁得天教授、高等医学院研究院李石洋教授、武汉大学基础医学院夏宇尘教授及德国海德堡癌症研究中心Mathias Heikenwalder合作在Nature Metabolism杂志在线发表新的研究论文“m6A modification-tuned sphingolipid metabolism regulates postnatal liver development in male mice”。该项研究揭示了m6A修饰的鞘脂代谢可以调节小鼠出生后的肝脏发育和代谢稳态,并探讨了Mettl3/m6A/Smpd3轴对鞘脂代谢的精细调控。

结果
01 Mettl3在出生后肝脏发育过程中表达降低
首先,研究团队基于转录组数据分析和差异基因分析发现,m6A甲基转移酶复合体的核心催化酶Mettl3和Mettl14随着肝脏发育过程而表达下降。其中,Mettl3主要表达在肝细胞中,研究发现,成年肝脏中肝细胞的Mettl3的表达远低于胚胎或者新生儿肝脏肝细胞中的表达(图1)。

图1 Mettl3在胚胎和新生儿肝脏中高表达,并在出生后肝脏发育过程中下降
02 Mettl3参与肝脏发育和功能成熟
因此,为研究m6A修饰在肝脏发育中的作用,研究者构建Mettl3ΔHep小鼠,胚胎期特异性在肝脏中敲除Mettl3(图2a,b)。结果显示,肝脏Mettl3基因的缺失导致m6A RNA水平降低,且Mettl3ΔHep小鼠在发育过程中表现出生长迟缓,同时,Mettl3ΔHep小鼠的血清谷丙转氨酶(ALT)和天冬氨酸转氨酶(AST)升高,肝脏组织表面粗糙,出现肝损伤表型(图2c-h)。进一步研究发现,Mettl3ΔHep小鼠肝脏组织中肝细胞肥大,细胞凋亡显著增加(图2i-m)。这些结果提示了特异性在肝脏中敲除Mettl3基因导致肝细胞代谢重塑和肝脏功能成熟缺陷。
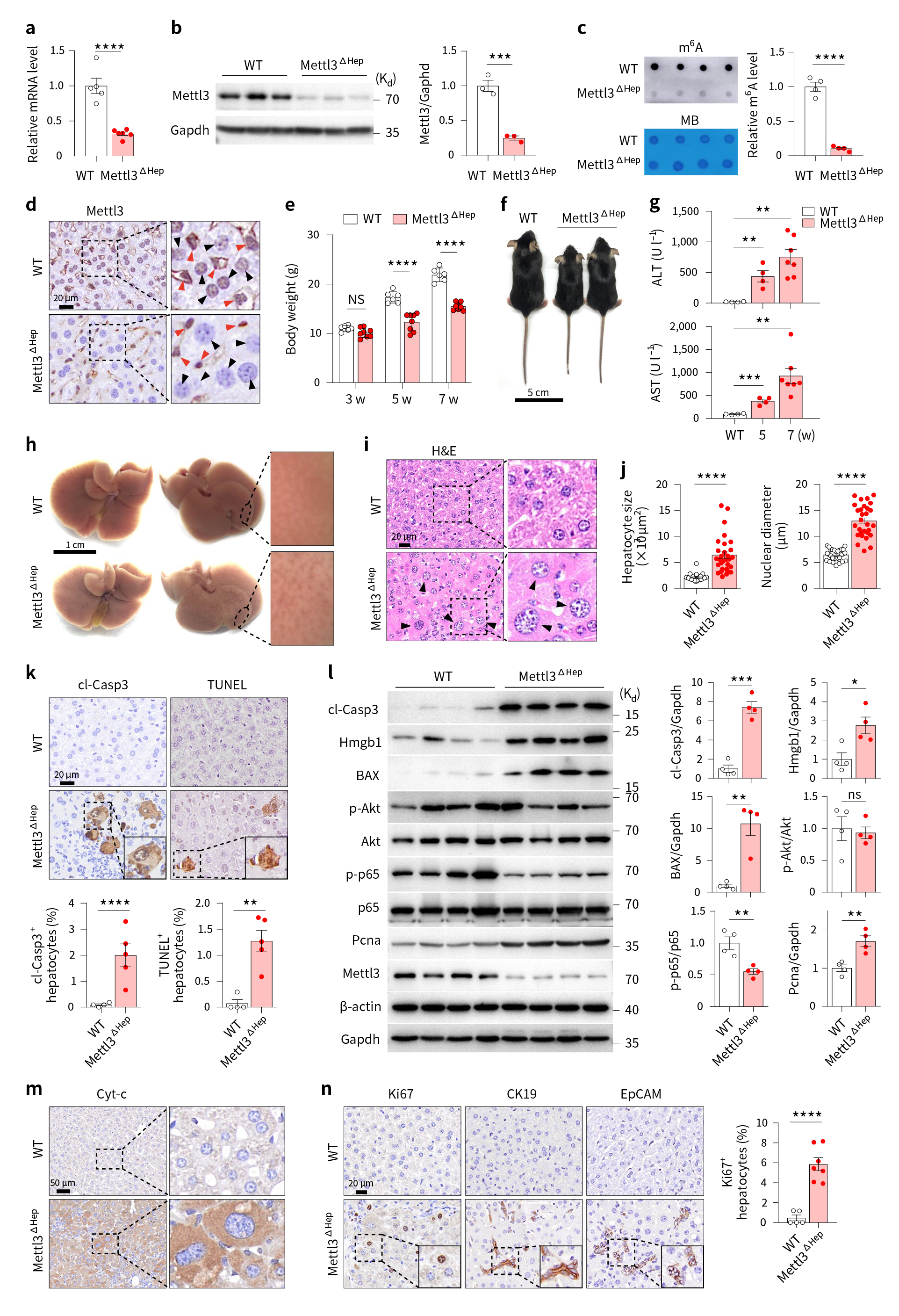
图2 肝脏Mettl3缺失导致肝细胞肥大、肝损伤和生长迟缓
随后,研究人员借助rAAV2/8-TBG-Cre注射1周龄Mettl3-floxed鼠(AAV8-Cre鼠),条件性敲除肝脏中Mettl3基因,结果并未观察到小鼠肝脏出现明显的损伤(图3a-c)。继续观察发现,3周龄的AAV8-Cre鼠肝脏m6A水平未表现出明显的降低(图3d-f)。这提示了Mettl3基因敲除对肝脏代谢稳态的影响与敲除时间点有关,在新生小鼠4周前,Mettl3介导的m6A修饰对于肝脏发育及功能成熟至关重要。
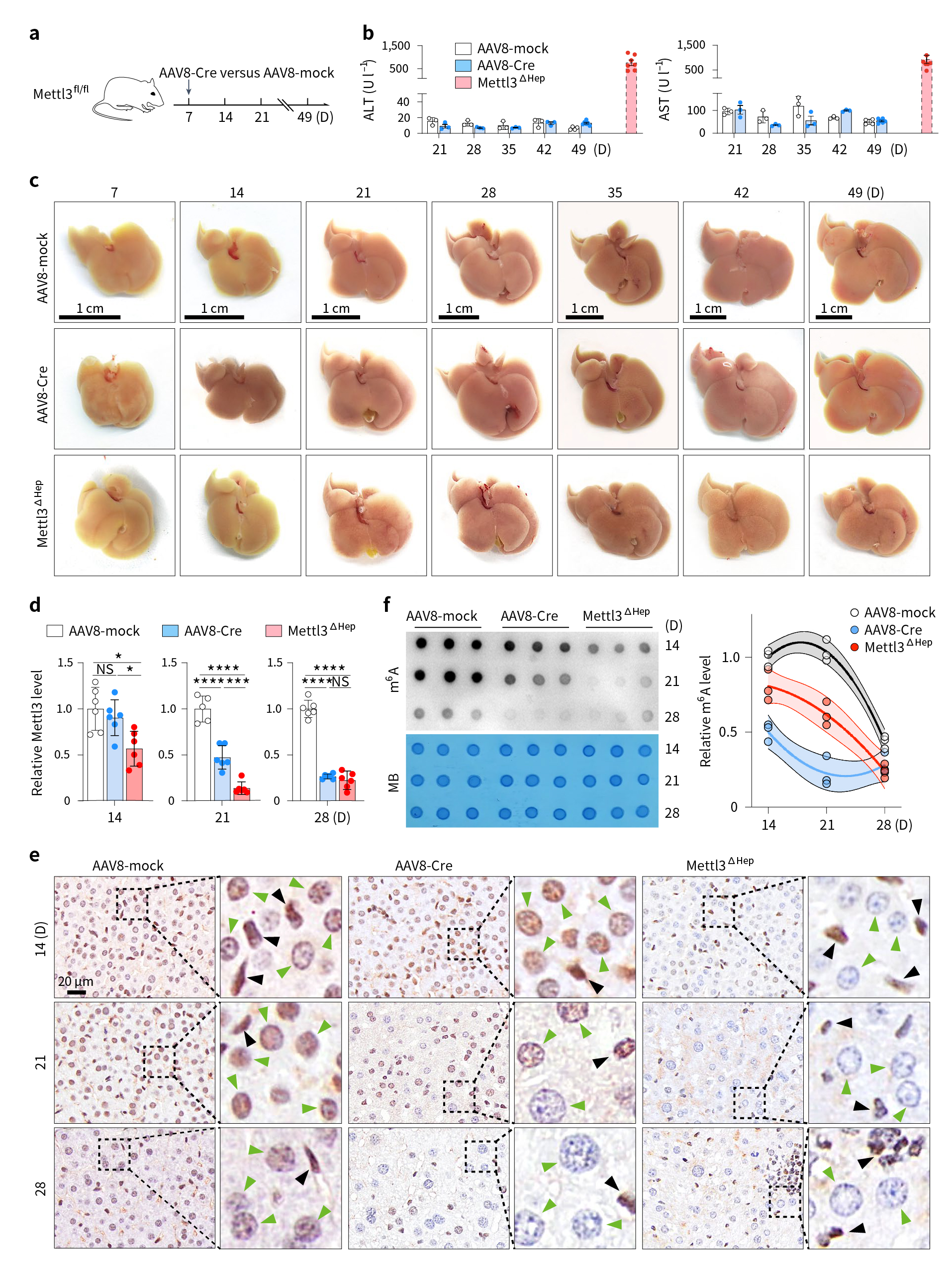
图3 小鼠出生后诱导肝细胞Mettl3表达下调不会引起肝损伤
03 MeMettl3/m6A/Smpd3轴对鞘脂代谢的精细调控机制
为进一步确定与发育缺陷密切相关的潜在靶基因,研究团队借助转录组分析及分子生物学技术发现,Mettl3ΔHep小鼠肝脏中神经鞘脂酰胺代谢的中性鞘脂酶Smpd3 mRNA水平和蛋白表达明显上调(图4)。
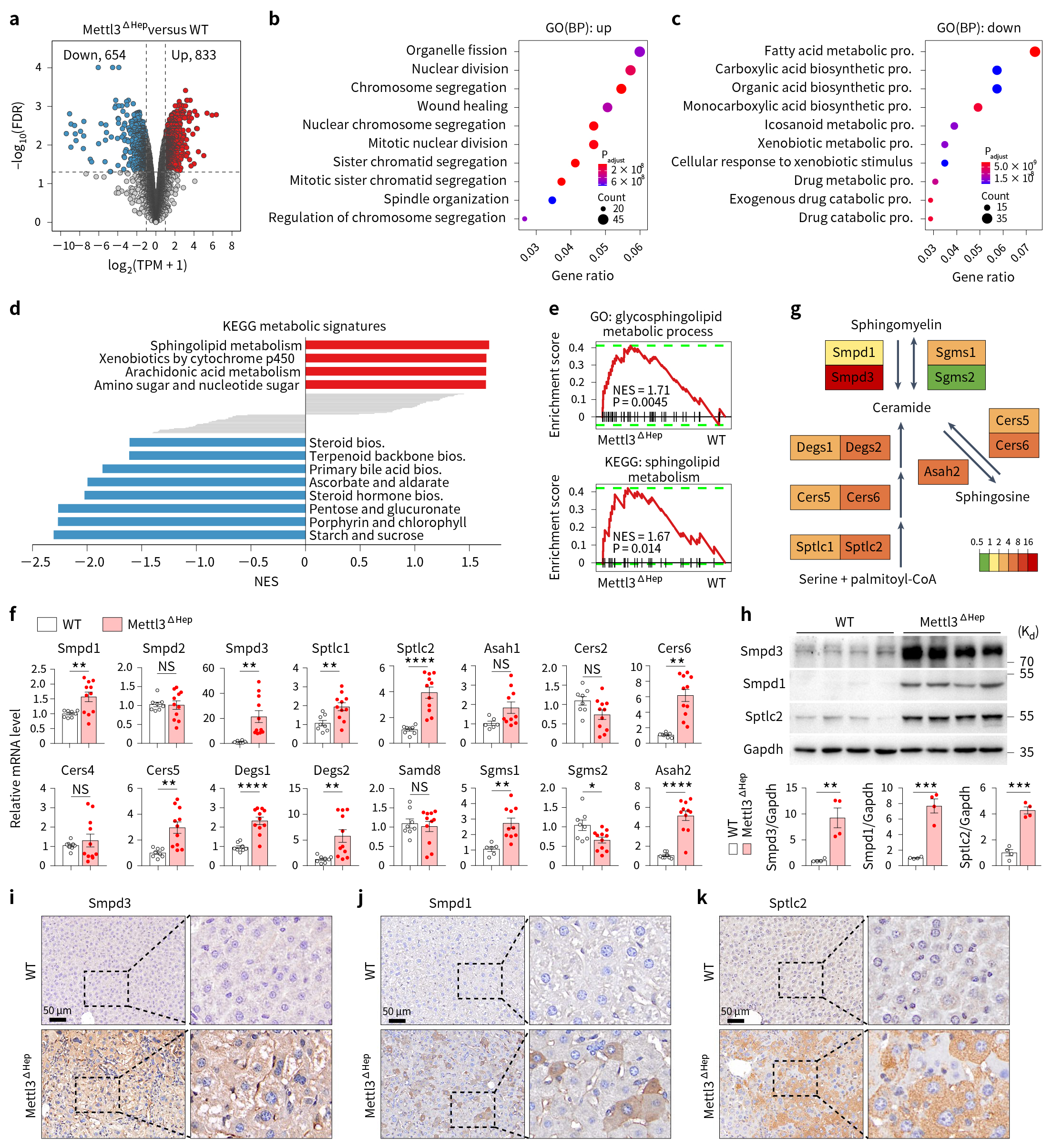
图4 Mettl3ΔHep小鼠肝脏发生鞘脂代谢重塑
进一步研究发现,Mettl3ΔHep小鼠肝脏中Smpd3 mRNA上的m6A修饰水平显著降低;而AAV8-Cre鼠肝脏中Smpd3转录水平从出生后4周开始增加,与出生后m6A水平呈负相关(图5i-l)。总的来说,小鼠出生后发育早期的肝脏Mettl3缺失导致Smpd3过早高表达,这是由于依赖Mettl3介导m6A修饰的RNA衰变缺陷造成的,在新生小鼠4周前,较高水平的Mettl3/m6A可作为制动器,阻碍了Smpd3的过早表达(图5)。
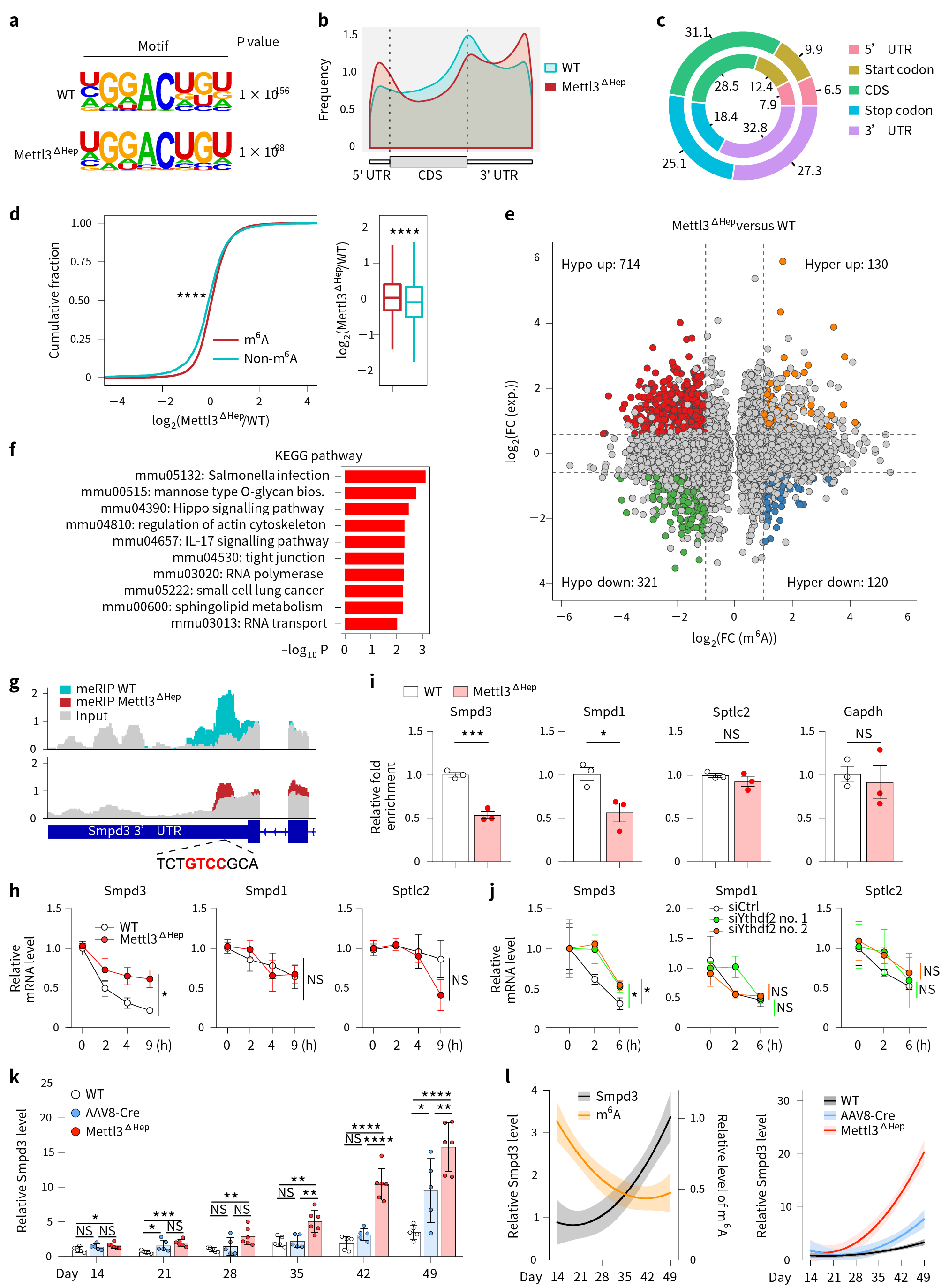
图5 Mettl3通过m6A修饰调控smpd3 mRNA衰变
接下来,作者探究了鞘脂代谢异常与Mettl3缺乏诱导的肝损伤之间的关系,借助液质联用(HPLC-MS)分析和电镜结果发现,Mettl3ΔHep小鼠肝脏中毒性神经酰胺堆积,线粒体损伤和内质网应激升高(图6)。
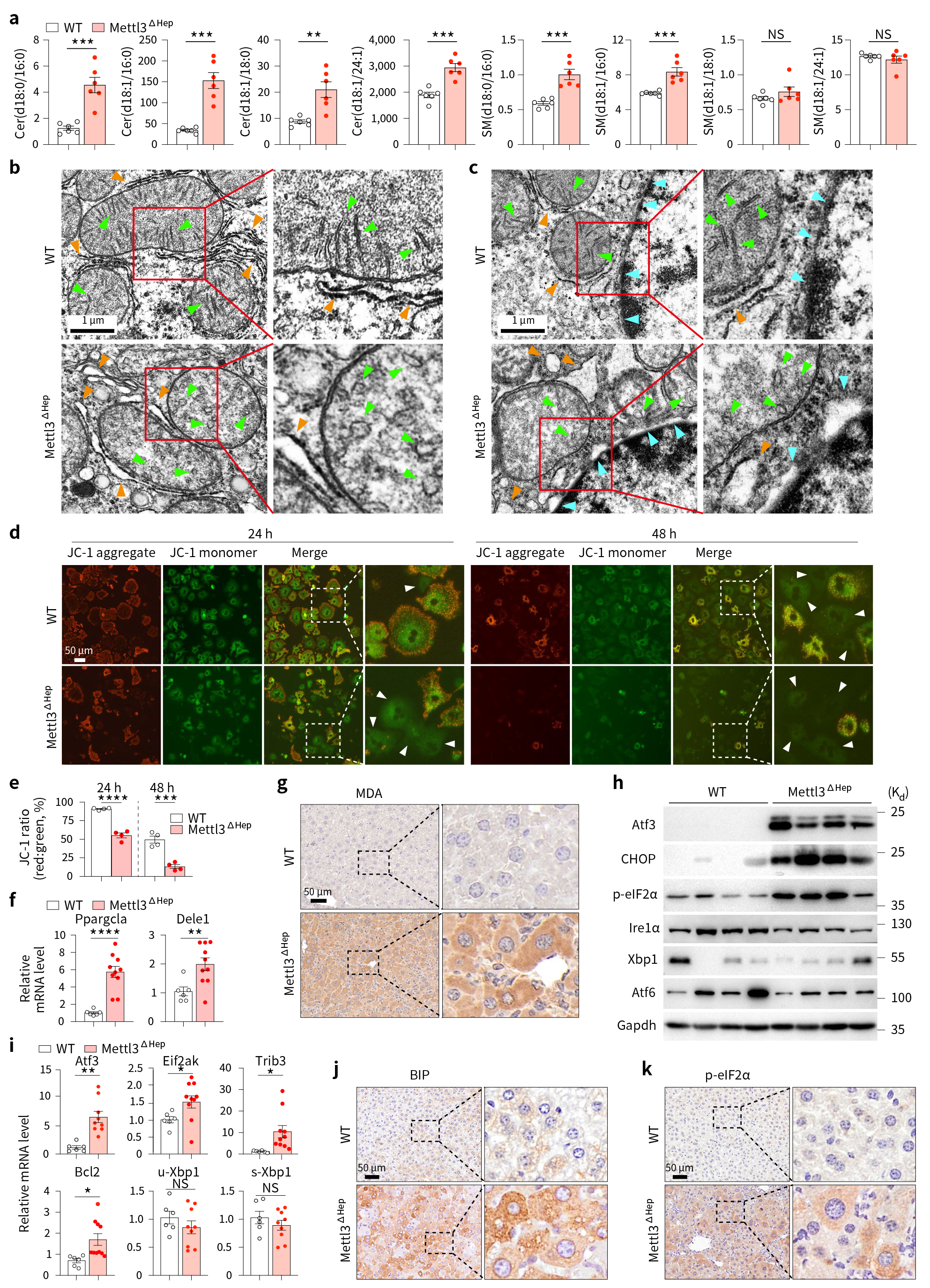
图6 Mettl3ΔHep小鼠肝脏中毒性神经酰胺堆积,线粒体损伤和内质网应激升高
04 下调Smpd3的表达有效改善肝脏发育和功能成熟缺陷
基于上述结果,作者分别借助Smpd3拮抗剂GW4869、Smpd3 siRNA和AAV过表达Sgms1(pAAV-CBh-Sgms1-3Xflag-P2A-EGFP-WPRE)以抵消Smpd3的方式下调Smpd3的表达(图7a,图8a),发现Smpd3表达降低,可有效逆转由Mettl3缺乏引起的肝损伤,神经酰胺堆积、肝线粒体变性和内质网异常得到了改善,小鼠体重也部分恢复(图7-8)。
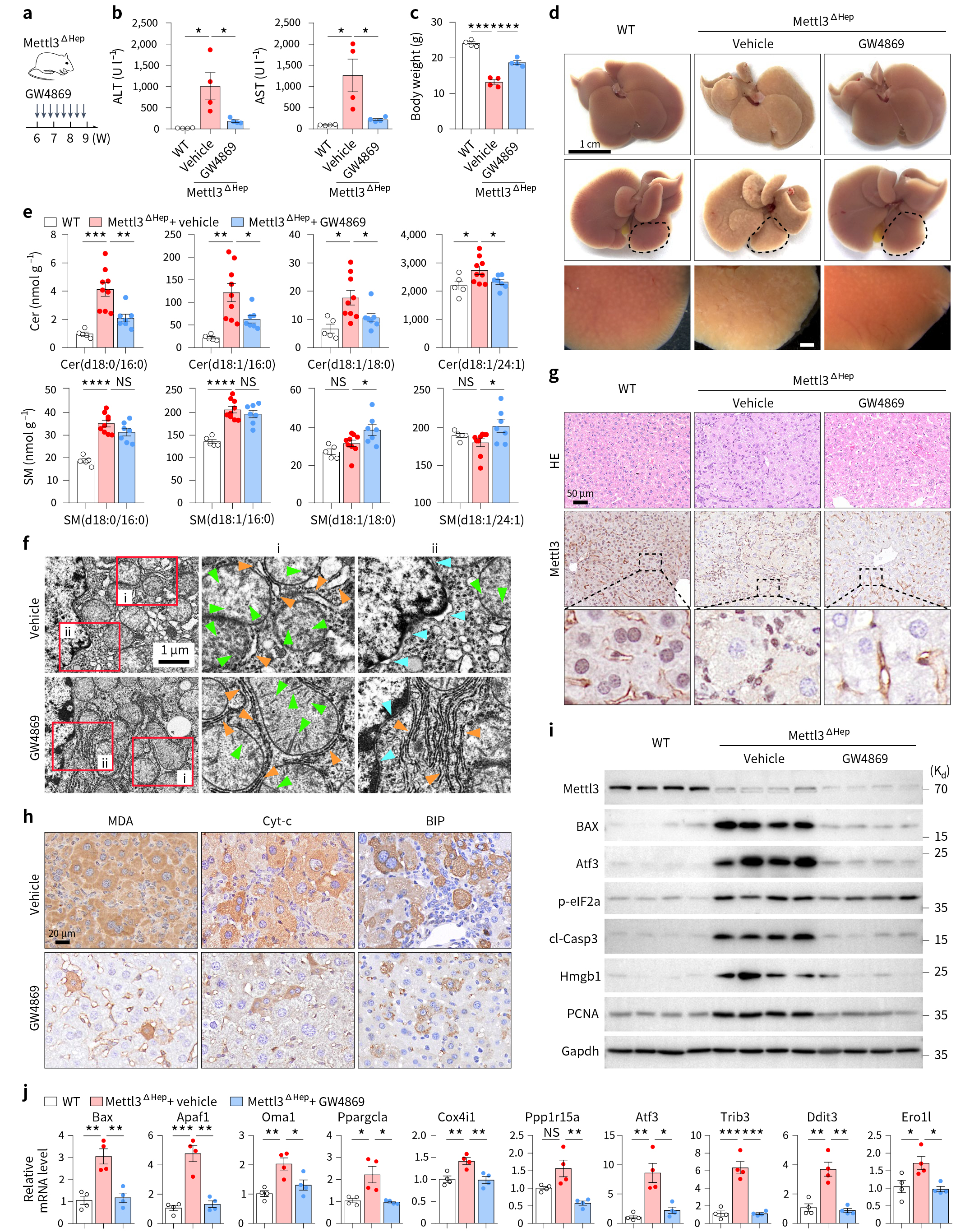
图7 药理学手段抑制Smpd3可减轻Mettl3缺陷引起的神经酰胺累积和肝损伤表型
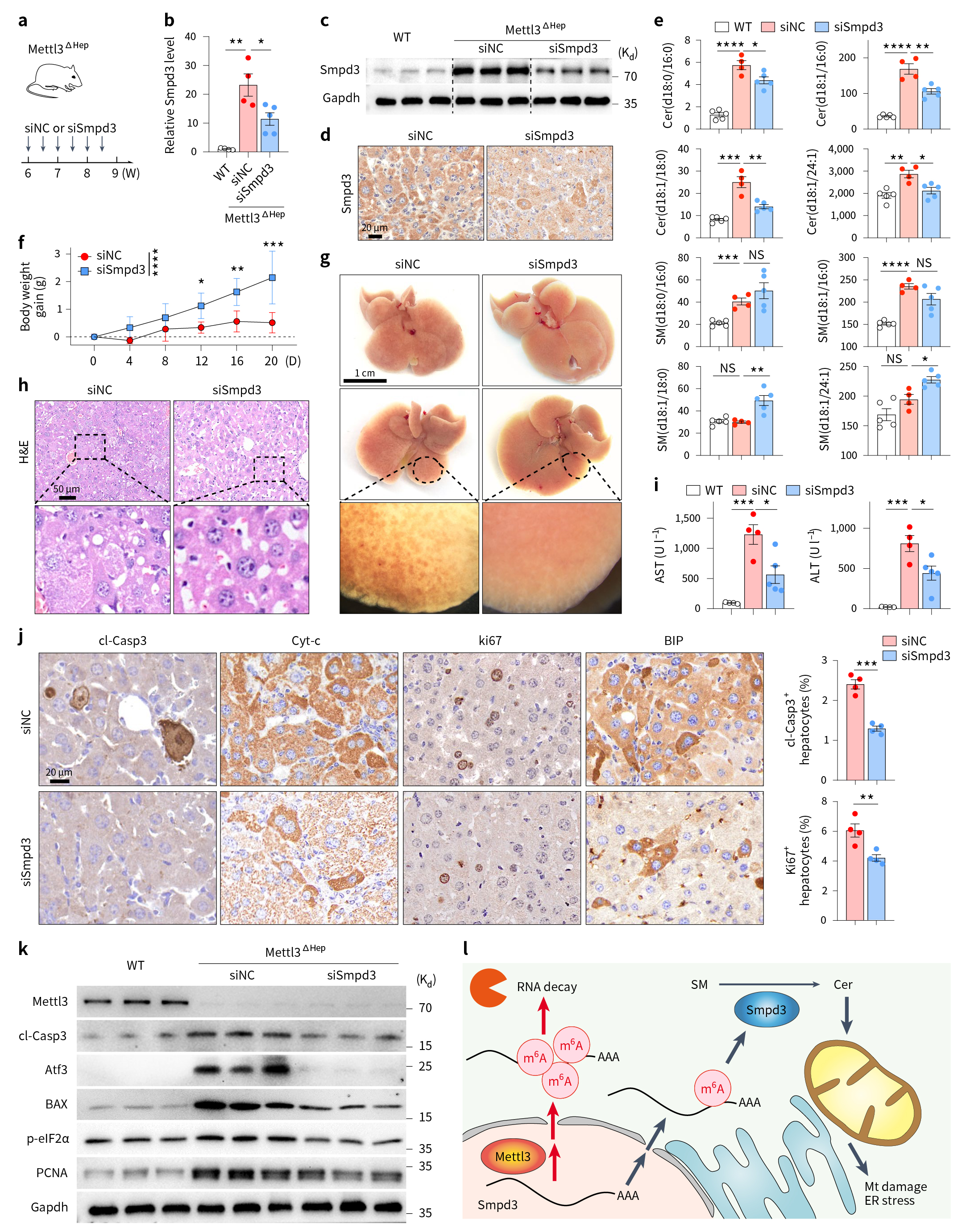
图8 Smpd3敲低可减轻肝脏Mettl3缺陷引起的神经酰胺累积和肝损伤表型
结论
本文借助转录组学、高通量测序、转基因小鼠、rAAV载体介导的条件性敲除、分子生物学等多种技术手段发现Mettl3基因的缺失导致肝细胞代谢重塑和功能成熟缺陷,且对肝脏代谢稳态的影响与基因敲除时间点有关。Smpd3作为Mettl3的靶标,参与鞘脂代谢的调控。Mettl3缺失导致Smpd3表达上调,进而介导鞘脂代谢重新连接,并伴随着毒性神经酰胺堆积以及线粒体损伤和内质网应激升高。在新生小鼠4周前,较高水平的Mettl3/m6A可作为制动器,通过严格调控Smpd3,保护出生后的肝脏免受过度鞘脂积累和代谢紊乱的影响。这项研究扩展了m6A修饰在维持发育阶段肝脏代谢稳态中的关键作用,为新生儿健康和肝脏发育的理解提供了强有力的支持。
该研究由山东大学基础医学院袁得天、高等医学院研究院李石洋、武汉大学基础医学院夏宇尘以及德国海德堡癌症研究中心 Mathias Heikenwalder 教授合作完成。山东大学基础医学院博士生王士冠、硕士生韩盼、青年教师孙建峰、深圳市呼吸疾病研究所研究员陈善泽为论文共同第一作者。
和元生物有幸为研究者提供实验中使用的AAV,以实际行动助力基础科学研究!
业务咨询

