【答疑解惑】类器官培养100问-血管共培养篇
类器官是由成体干细胞或多能干细胞诱导分化并经体外3D环境培养的细胞团,具备主要组织或器官的三维结构与生理功能。然而,大部分的类器官缺乏血管网络的支持,这限制了其形态大小和发育状态,导致无法完全模拟人体内真实的组织器官。血管化问题是在类器官研究领域中的一个重要挑战。
血管化类器官构建的主要挑战在于如何有效地形成和维持血管网络,以确保类器官内部细胞的营养供应和代谢废物排出。血管化过程涉及复杂的生物学机制,包括血管发生和血管生成等,这些过程需要精确的调控和适当的培养条件。其中,类器官/血管共培养是实现类器官血管化的一种重要方法。为此,小编针对类器官/血管共培养体系的细胞来源、培养方式、培养条件的优化、共培后类器官的功能鉴定及定位等常见问题进行了汇总整理,欢迎感兴趣的老师一起交流讨论!
Q1:为了弥补单一类器官在应用上的不足,目前我们可以选择哪些共培养模型?
A1:
1、免疫微环境共培养(包括T、NK、CAF等免疫微环境中的各类细胞);
2、血管共培养;
3、间充质细胞共培养;
4、神经网络共培养;
5、不同种类的类器官共培养;
6、作为感染模型共培养(如:病毒、细菌等共培养)。
Q2:当我们需要做体外类器官血管化培养时,可以选用哪些来源的细胞作为类器官中“血管”的部分?
A2:
1、内皮细胞。Takebe等人【1】将iPSC衍生的肝内胚层、人脐静脉内皮细胞(HUVECs)和人骨髓间充质干细胞(MSCs)接种在Matrigel中,培育出了血管化的肝芽(LBs);
2、干细胞。如:iPSC、ESC可以分化为血管内皮细胞或血管类器官;
3、类器官共分化。通过诱导人多能干细胞同时向血管谱系和特定类器官谱系分化,以产生具有血管样结构的类器官【2】。
Q3:类器官与血管共培养有哪些方面的应用?
A3:
1、血管系统发挥着运输营养物质、氧气、代谢废物等重要作用,在缺乏可灌注的血管系统模型中,类器官仅依靠被动扩散来交换营养物质、氧气和代谢废物,如果尺寸过大,会逐渐导致类器官的核心坏死【3】;
2、使用这些血管类器官来模拟疾病进程中的血管病变。如:通过构建干细胞诱导分化(iPSC)的血管类器官模型,可以用于阿尔茨海默病、心血管疾病、伤口愈合、中风、癌症和糖尿病等一系列血管相关疾病的病因和治疗方法研究【4】;
3、作为抑制血管生成药物的效果评价模型。如:靶向血管内皮生长因子/血管内皮生长因子受体的药物正在用于治疗耐药和转移性结直肠癌的研究【5】;
4、作为特定的研究模型。如:血管类器官(BVOs)可以重现发育过程中血管的结构和功能,并且BVOs浸润脑类器官从而形成血脑屏障(BBB)模型【6】。
Q4:类器官的血管共培养有哪些方式?
A4:
1、使用内皮细胞包裹类器官共培养。如:将人内皮细胞嵌入基质胶中,并在其中添加早期类器官(如图1)。随着时间的流逝,这会导致人类内皮细胞自组装成类器官外围的毛细血管并侵入形成血管网络。当然这种方式可以在类器官的外围形成明显的血管网络,但在类器官中心的血管网络形成较少【7】;
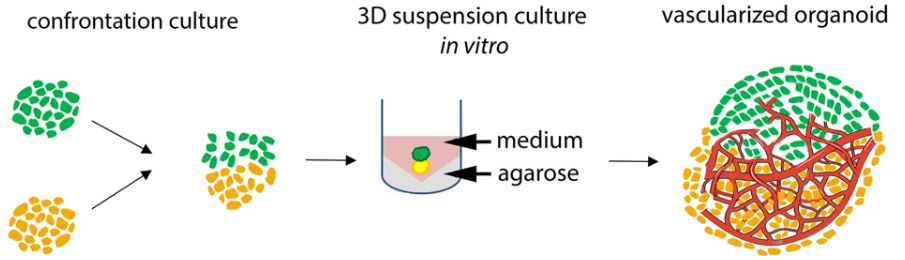
图1. 内皮细胞包裹类器官共培养流程示意图【7】
2、干细胞与血管内皮细胞均匀混合后共培养。如:将hESCs或iPSCs与人脐静脉内皮细胞(HUVECs)共培养,定向诱导其分化为血管化的脑类器官(如图2)。免疫荧光染色结果表明,HUVECs在脑类器官中相互连接,并形成具有通透能力的复杂血管系统,该血管系统可以在脑类器官中可稳定存在200天以上【8】;
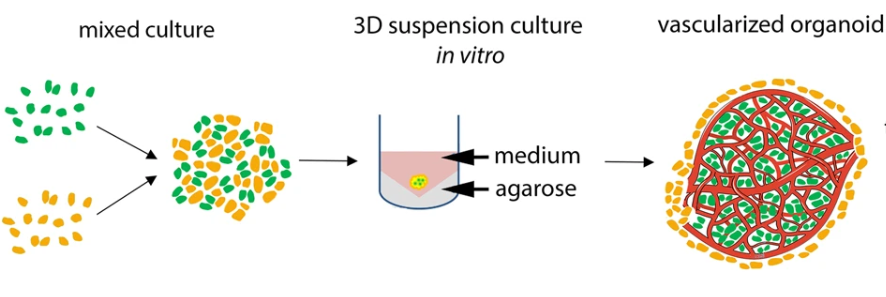
图2. 干细胞与血管内皮细胞均匀混合后共培养流程示意图【7】
3、诱导自发血管化。如:通过动态调节WNT信号通路,控制近端肾小球和远端肾小管的比例,调节近端足细胞释放血管内皮生长因子A(VEGFA)的水平,进而可诱导血管化的肾脏类器官分化形成【9】;
4、移植到体内形成血管结构。如:在体外将人胚胎干细胞(hESC)诱导分化为脑类器官后,直接移植入免疫缺陷小鼠软脑膜血管上。移植的类器官继续进行分化和成熟,并与小鼠脑组织进行了很好的整合,双光子扫描成像结果显示小鼠血管侵入移植物并生长延伸,血管内血流活跃,移植物类器官功能性血管网络发展良好【10】。
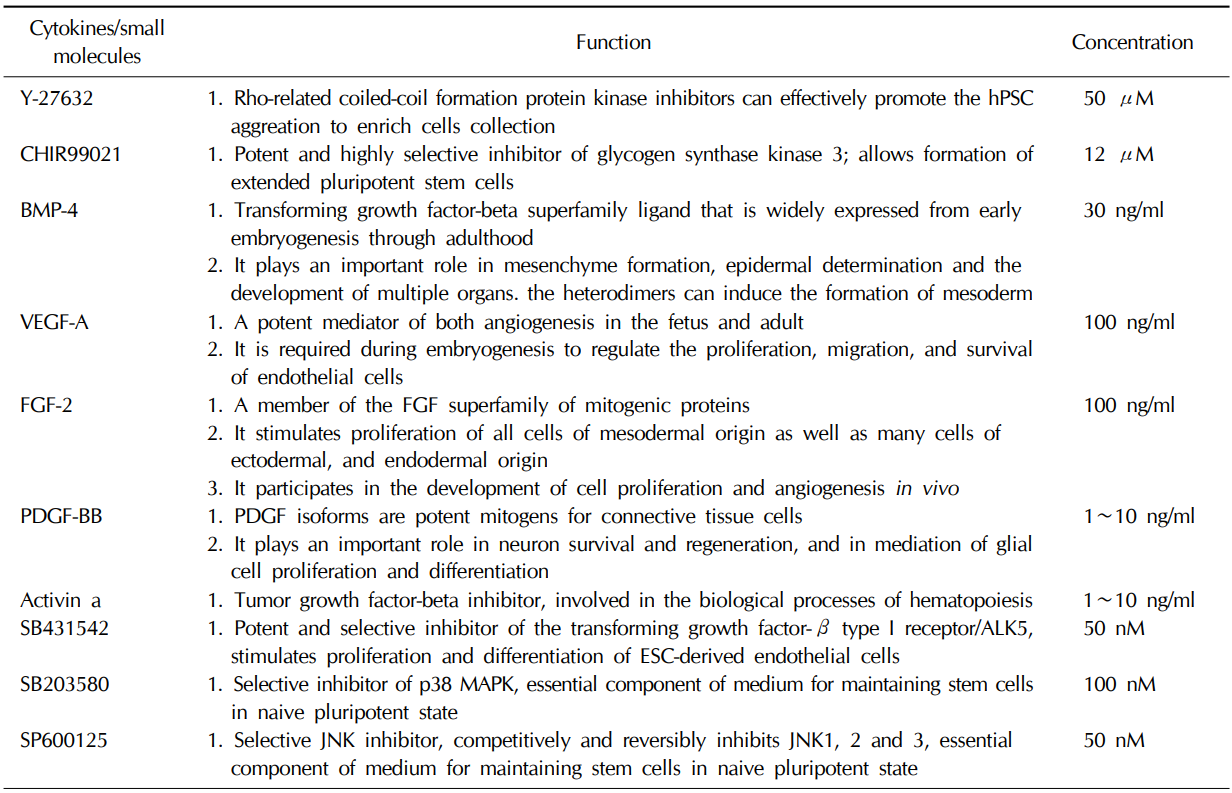
Q5:有哪些细胞因子/小分子可以促使干细胞向血管分化?
A5:干细胞在分化过程中,受不同的信号通路调控。那么激活/抑制特定的通路就要通过添加不同的细胞因子/小分子来实现。
下表总结了血管分化途径中所需的细胞因子/小分子,以及在分化过程中行使的功能【11】。
表1. 血管类器官培养中所需的细胞因子和小分子【11】
Q6:血管化后的类器官有哪些可检测的特征和功能?
A6:
1、具有血管的一些表型特征,如:在含有凝胶的3D培养体系下,血管内皮细胞可以自发形成血管网络;能够表达内皮细胞(CD31)、周细胞(PDGFR-β)、血管基底膜(Col IV)等相应的血管特征标志物(如图3);
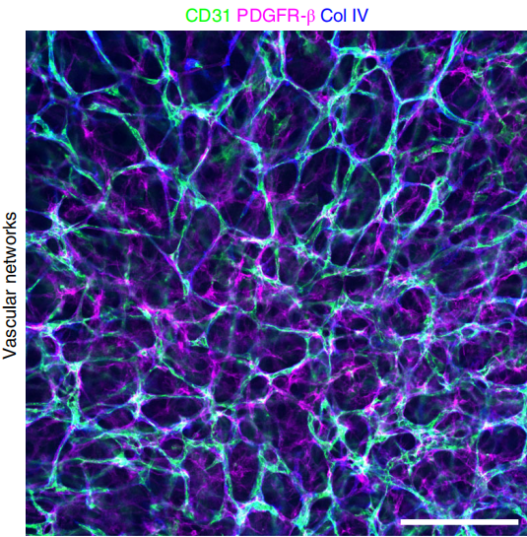
图3. 从人多能干细胞分化出来的血管网络,和血管类器官的特征标志物【12】
2、能够分泌多种因子,调节目的细胞的发育成熟,如:与单独培养的脑类器官相比,血管化的脑类器官中神经元更成熟【8】;
3、具有一定的可灌注功能,如:向血管化的类器官中灌注FITC-葡聚糖,通过检测类器官内部的FITC信号,确定血管是否具有可灌注的功能【13】;
4、与未血管化的类器官相比,能够更好地维持类器官的长时间生长,凋亡信号更低【14】;
5、与某些类器官共培养时能够执行功能,如:与脑类器官共培养可以形成血脑屏障;
6、在体内移植类器官过程中,血管系统可以募集宿主ECs来重建功能性血管系统,并促进血液流入移植物,提高移植物的存活率【8】;
Q7:在类器官血管化的模型中,如何有效地定位血管?
A7:
1、如果需要实时观察血管的生成情况,可以将内皮细胞预先进行荧光标记,在培养过程中可以在荧光显微镜下观察血管结构【15】;
2、由于内皮细胞在凝胶培养体系中易成管,因此可以在培养过程中使用荧光标记的液体灌注,在荧光显微镜下可以观察到清晰的血管结构【16】;
3、可以将培养物固定后,通过免疫荧光鉴定出血管内皮细胞的位置。
Q8:和单一类器官培养体系相比,类器官-血管这种共培养的体系需要如何调整?
A8:通常是两种培养基按照1:1(v/v)混合,便于维持两种模型的生长。当然这并不一定是最优的培养体系,如果有需要可以进行不同配比和其他体系的优化。
Q9:不同组织的血管化模型是一致的吗?
A9:不是的,由于身体的每个组织都有自己独特的结构、细胞组成和功能,那么我们构建的血管化类器官也要匹配对应组织的特性,这些差异主要包括不同的血管网络结构、内皮细胞表型等特征。例如:肌肉、脂肪或血脑屏障等组织中的ECs可以是“连续的”,细胞与细胞之间紧密地连接在一起,限制了通透性;而在一些内分泌组织中,ECs可以是“不连续的”,细胞之间有间隙,可以允许更大的分子进行交换【17】。
Q10:可以实现不同类型的类器官共培养吗?
A10:已有研究通过将肝脏和胰岛类器官进行共培养,构建了2型糖尿病(T2DM)疾病模型(如图4)【18】,这种多类器官系统可以在生理和病理条件下体外模拟肝-胰岛轴,为今后 T2DM 发病机制研究和药物开发提供了独特的研究平台。
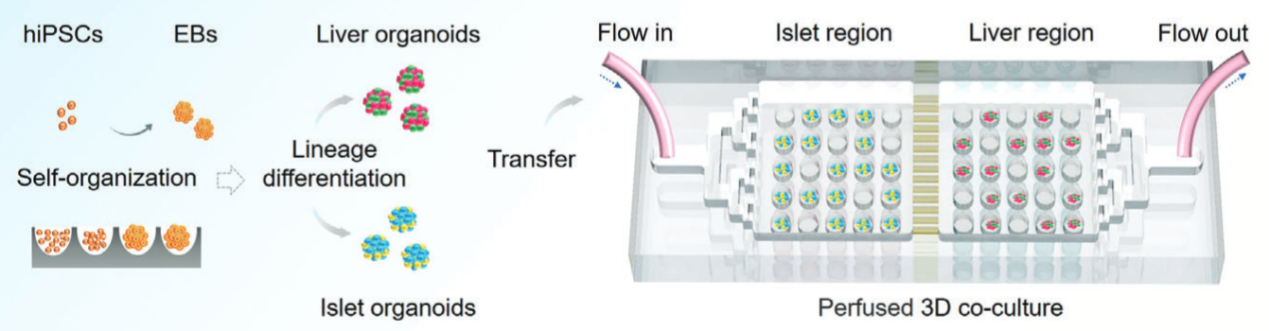
图4. 在微孔设备中共培养肝脏和胰岛类器官【18】
Takebe等人利用hPSC的三维分化方法产生多内胚层结构域,在前肠-中肠边界形成了视黄酸依赖的肝胆胰脏器官结构,在体外实现了人肝-胆-胰(hepato-biliary-pancreatic, HBP)类器官的共培养【19】。
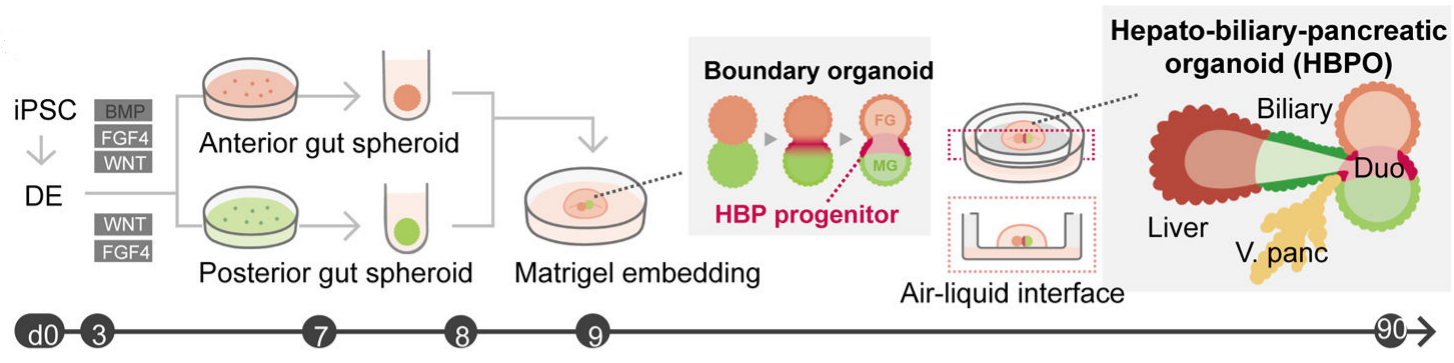
图5. hPSC诱导分化为HBP类器官的原理图【19】
近岸蛋白依靠专业的研发团队,精心打造类器官验证平台,致力于为广大类器官客户提供经验证、高活性、可信任的类器官培养产品。近岸蛋白可提供自主研发生产的30余种类器官培养相关细胞因子,如Activin A、BMP-4、Wnt3a、R-Spondin、Noggin、EGF、FGFs等高活性、高稳定性细胞因子,以及一系列类器官培养基,涵盖肠癌、肺癌、肝癌、乳腺癌、胰腺癌、肾癌、卵巢癌等肿瘤类器官以及正常肝/肺类器官完全培养基,经过类器官培养验证,专为类器官培养开发,产品适用性高,已广泛应用于企业和科研院所,让您的类器官培养更可控!
类器官培养细胞因子产品
|
类器官培养类型 |
相关因子 |
|
胃类器官 |
Activin A、BMP-4、EGF、FGF-4、FGF-10、Noggin、 R-spondin 1、Wnt3a
|
|
肠类器官 |
Activin A、BMP-4、EGF、FGF-4、Noggin、R-spondin 1、Wnt3a |
|
肝类器官 |
Activin A、BMP-4、BMP-7、FGF-7、FGF-10、FGF-19、HGF、OSM、R-Spondin 1 |
|
肺类器官 |
Activin A、FGF-4、FGF-7、FGF-10、Noggin、SHH、Wnt3a |
|
前列腺类器官 |
EGF、FGF-10、Noggin、R-spondin 1、Wnt-3a |
|
脑类器官 |
BDNF、EGF、FGF basic、GDNF、NT-3 |
|
内耳类器官 |
BMP-4、FGF basic |
|
视网膜类器官 |
SHH、Wnt-3a |
|
乳腺类器官 |
EGF、FGF basic、FGF-7、FGF-10、Heregulinβ-1、Noggin、R-Spondin 1、R-Spondin 3、Wnt-3a |
|
肾脏类器官 |
BMP-2、BMP-4、BMP-7、FGF basic、FGF-9、Activin A、FGF-7、GDNF、R-Spondin 1 |
|
心脏类器官 |
Activin A、BMP-4、FGF basic、TGF-beta 1、Transferrin |
|
血管类器官 |
BMP-4、FGF basic、VEGF |
类器官培养基产品
|
目录号 |
产品名称 |
|
OCMHC01 |
Intestinal Cancer(肠癌)Organoid Culture Medium |
|
OCMHC02 |
Renal Cancer(肾癌)Organoid Culture Medium |
|
OCMHC03 |
Brain Glioma(脑胶质瘤)Organoid Culture Medium |
|
OCMHC04 |
Liver Cancer(肝癌)Organoid Culture Medium |
|
OCMHC05 |
Lung Cancer(肺癌)Organoid Culture Medium |
|
OCMHC06 |
Breast Cancer(乳腺癌)Organoid Culture Medium |
|
OCMHC07 |
Gastric Cancer(胃癌) Organoid Culture Medium |
|
OCMHC08 |
Pancreatic Cancer(胰腺癌)Organoid Culture Medium |
|
OCMHC09 |
Esophageal cancer(食管癌)Organoid Culture Medium |
|
OCMHC10 |
Cervical carcinoma(宫颈癌)Organoid Culture Medium |
|
OCMHC11 |
Thyroid carcinoma(甲状腺癌) Organoid Culture Medium |
|
OCMHC12 |
Prostatic cancer(前列腺癌) Organoid Culture Medium |
|
OCMHC13 |
Bladder Cancer(膀胱癌) Organoid Culture Medium |
|
OCMHC14 |
Ovarian Cancer (卵巢癌)Organoid Culture Medium |
|
OCMMN01 |
Mouse Intestinal (小鼠小肠)Organoid Culture Medium |
|
OCMMN02 |
Mouse Colonic (小鼠结肠)Organoid Culture Medium |
|
OCMHN01 |
Liver Organoid (肝扩增)Expansion Medium |
|
OCMHN02 |
Liver Organoid (肝分化) Differentiation Medium |
|
OCMHN03 |
Lung Organoid (肺扩增) Culture Medium |
参考文献
【1】Takebe, T. et al. (2013). Vascularized and functional human liver from an iPSC-derived organ bud transplant. Nature, 499(7459), 481-484.
【2】Cui, K. et al. (2023). Engineering placenta‐like organoids containing endogenous vascular cells from human‐induced pluripotent stem cells. Bioengineering & Translational Medicine, 8(1), e10390.
【3】Pham, M. T. et al. (2018). Generation of human vascularized brain organoids. Neuroreport, 29(7), 588-593.
【4】Wimmer, R. A. et al. (2019). Human blood vessel organoids as a model of diabetic vasculopathy. Nature, 565(7740), 505-510.
【5】Al Bitar, S. et al. (2023). Molecular mechanisms targeting drug-resistance and metastasis in colorectal cancer: Updates and beyond. World Journal of Gastroenterology, 29(9), 1395.
【6】Ahn, Y. et al. (2021). Human blood vessel organoids penetrate human cerebral organoids and form a vessel-like system. Cells, 10(8), 2036.
【7】Wörsdörfer, P. et al. (2019). Generation of complex human organoid models including vascular networks by incorporation of mesodermal progenitor cells. Scientific reports, 9(1), 15663.
【8】Shi, Y. et al. (2020). Vascularized human cortical organoids (vOrganoids) model cortical development in vivo. PLoS biology, 18(5), e3000705.
【9】Low, J. H. et al. (2019). Generation of human PSC-derived kidney organoids with patterned nephron segments and a de novo vascular network. Cell stem cell, 25(3), 373-387.
【10】Mansour, A. A. et al. (2018). An in vivo model of functional and vascularized human brain organoids. Nature biotechnology, 36(5), 432-441.
【11】Yu, J. (2021). Vascularized organoids: a more complete model. International Journal of Stem Cells, 14(2), 127.
【12】Wimmer, R. A. et al. (2019). Generation of blood vessel organoids from human pluripotent stem cells. Nature protocols, 14(11), 3082-3100.
【13】Frenkel, N. et al. (2021). Long-lived human lymphatic endothelial cells to study lymphatic biology and Lymphatic Vessel/Tumor Coculture in a 3D Microfluidic Model. ACS Biomaterials Science & Engineering, 7(7), 3030-3042.
【14】Cakir, B. et al. (2019). Engineering of human brain organoids with a functional vascular-like system. Nature methods, 16(11), 1169-1175.
【15】Rajasekar, S. et al. (2020). IFlowPlate—A customized 384‐well plate for the culture of perfusable vascularized colon organoids. Advanced materials, 32(46), 2002974.
【16】Bonanini, F. et al. (2022). In vitro grafting of hepatic spheroids and organoids on a microfluidic vascular bed. Angiogenesis, 25(4), 455-470.
【17】Strobel, H. A. et al. (2023). Vascularized tissue organoids. Bioengineering, 10(2), 124.
【18】Tao, T. et al. (2022). Microengineered multi‐organoid system from hiPSCs to recapitulate human liver‐islet axis in normal and type 2 diabetes. Advanced Science, 9(5), 2103495.
【19】Koike, H., et al. (2019). Modelling human hepato-biliary-pancreatic organogenesis from the foregut–midgut boundary. Nature, 574(7776), 112-116.
