肝再生是一个错综复杂的过程,涉及多种细胞类型的增殖,多种细胞因子、肝脏微环境及细胞内信号通路的精密调控。然而,其潜在的分子机制并不完全清楚。
今年9月,四川大学华西医院曾勇教授团队在 Signal transduction and target therapy(STTT) 发表文章“MDIG-Mediated H3K9me3 demethylation Upregulates Myc by Activating OTX2 and Facilitates Liver Regeneration”。在这里,研究人员通过采用MDIG肝脏特异性敲除小鼠建立不同肝损伤模型探索和验证了组蛋白甲基化酶MDIG在肝再生过程中的生物学功能及其作用机制。
研究背景
哺乳动物肝脏具有强大的再生能力,可以在肝脏受损后的几周内成功地将肝脏质量和功能恢复至损伤前状态。然而,临床上存在一部分因外伤、肿瘤、肝硬化等需行部分肝切除术的患者,因切除肝脏体积过大易出现肝衰竭,严重影响患者预后。虽然肝移植是有效治疗途径,但供体不足限制了肝移植的应用。因此,研究肝再生的分子调控机制,探索新的治疗策略对于临床面临的困境具有重要的现实意义。
有研究显示组蛋白乙酰化、m6A 修饰和 DNA 甲基化相关的表观遗传修饰参与肝再生过程。本研究中,我们主要从组蛋白甲基化的角度探索肝再生过程中的调控机制。组蛋白甲基化酶MDIG,主要包含一个保守的JmjC区域,能够去甲基化H3K9me3。有研究表明MDIG在调控细胞周期促进细胞增殖中发挥重要作用。这里,我们探索和验证了MDIG在肝再生过程中发挥的作用及可能的机制。
研究结果
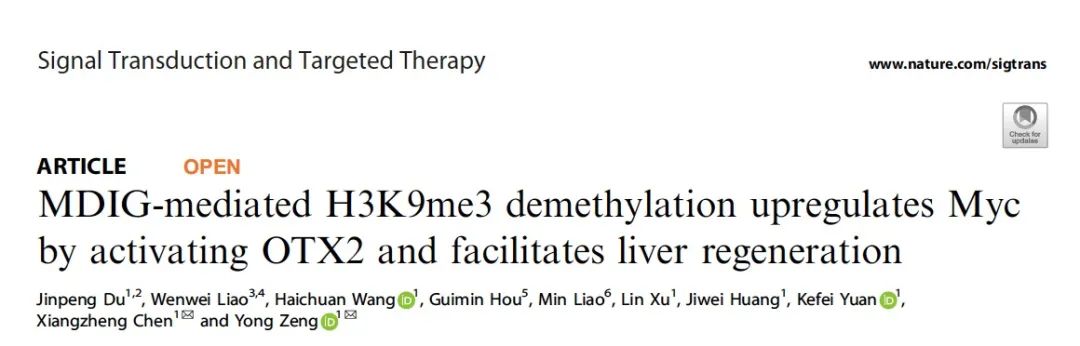
首先,在正常小鼠的肝再生模型中,我们发现MDIG的表达呈现先升高再降低的趋势,而H3K9me3则呈相反趋势,同时我们发现在肝再生过程中,肝脏细胞和胆管细胞均相应表达MDIG,并且MDIG的表达在整个残肝恢复过程中从近中央区向近门管区扩展。因此,初步推测MDIG可能通过发挥去甲基化H3K9me3的特性参与小鼠肝再生过程。接着,我们构建了MDIG肝脏特异性敲除小鼠,并在此基础上建立了2/3肝切除和CCL4急性肝损伤两种动物模型,分别设立7个不同时间点。结果显示,当敲除MDIG后,术后小鼠残肝再生速率明显下降,细胞周期受到影响,肝再生恢复过程受阻,在CCL4模型中也得到了一致的结果(图1)。
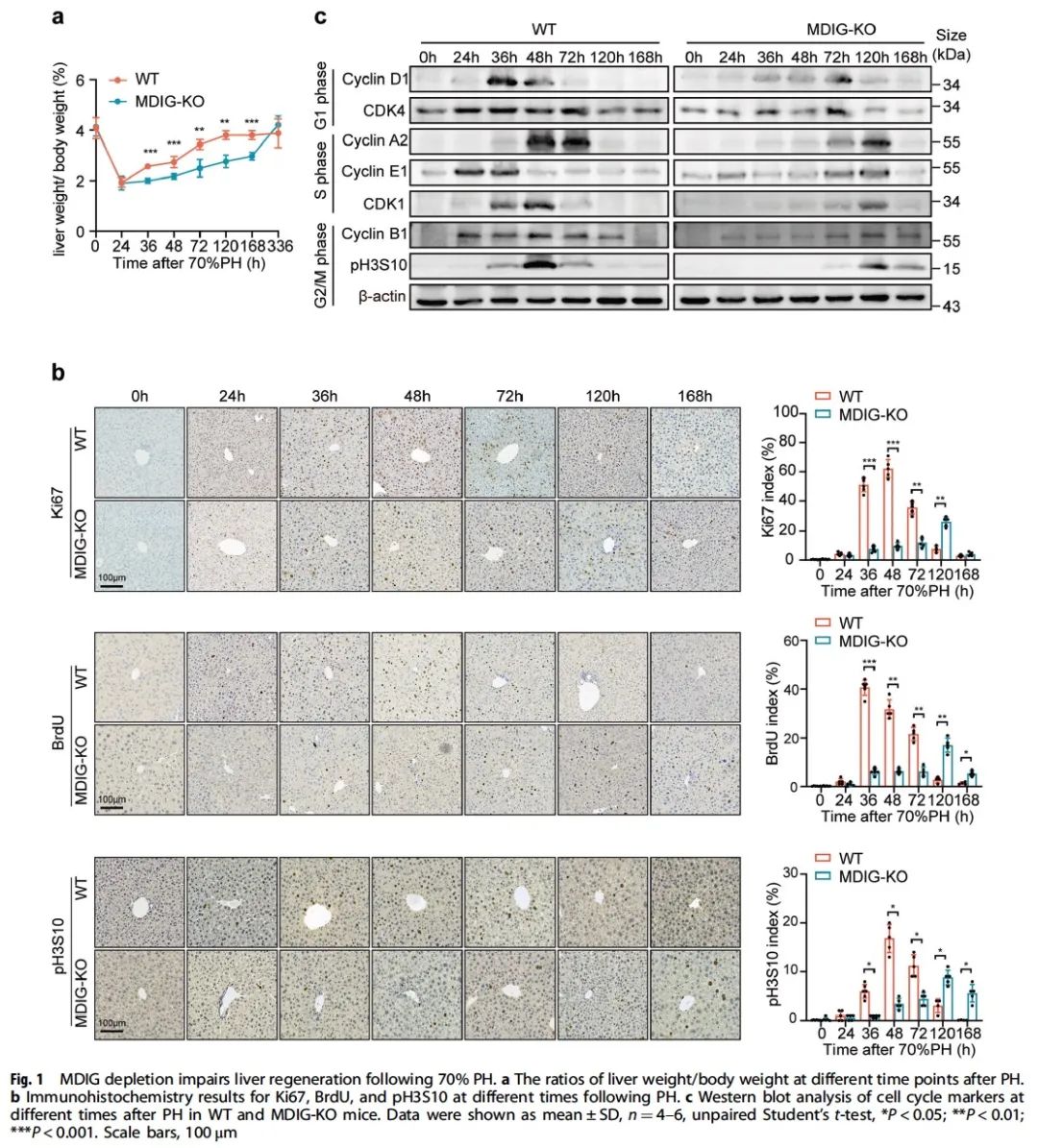
为了深入探索MDIG在再生过程中的具体作用机制,我们采用RNA-seq测序并验证后发现MYC为MDIG下游的一个关键效应子,并在细胞和动物层面证明了MDIG影响肝再生的过程依赖于MYC对细胞增值调控的作用(图3)。
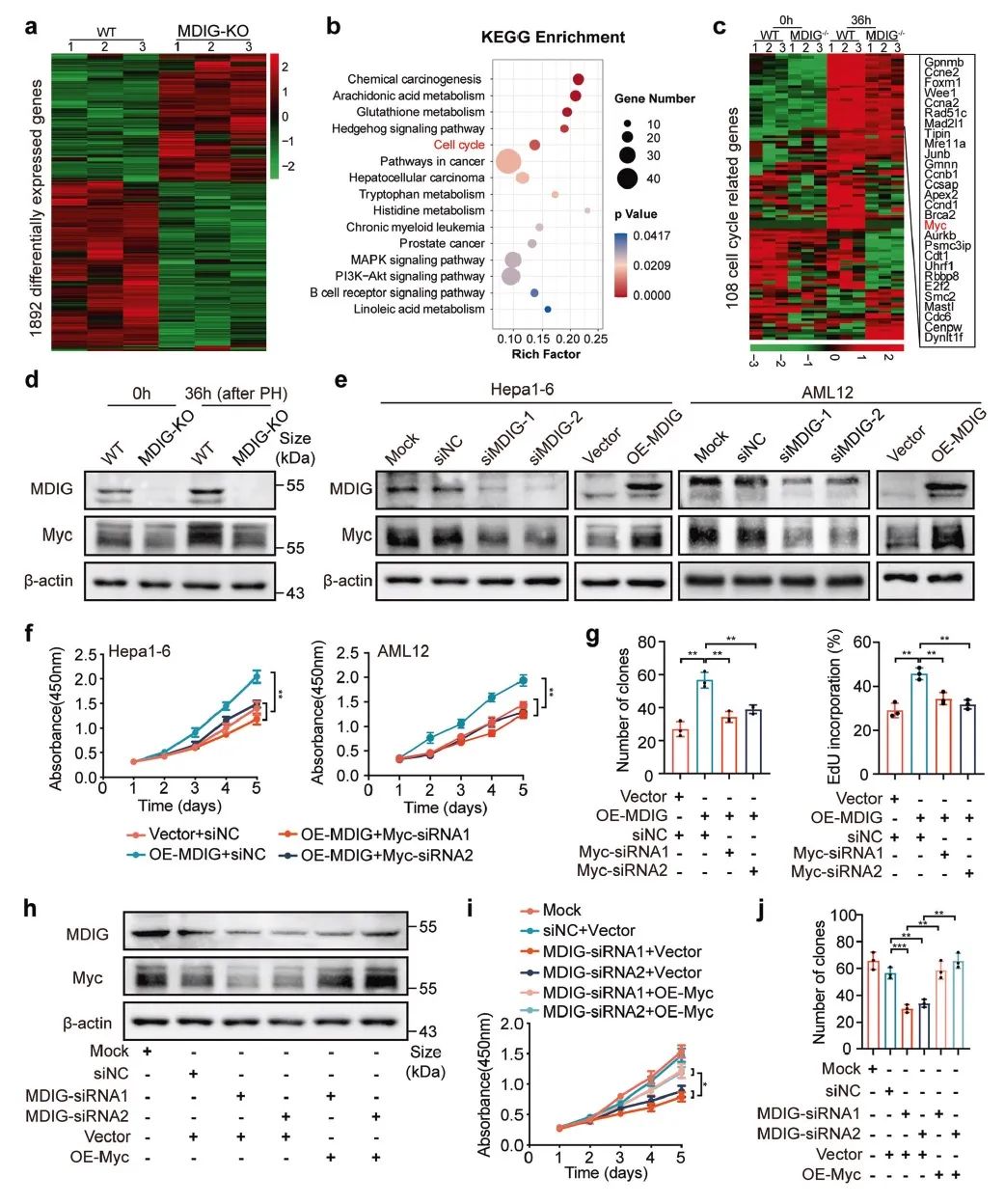
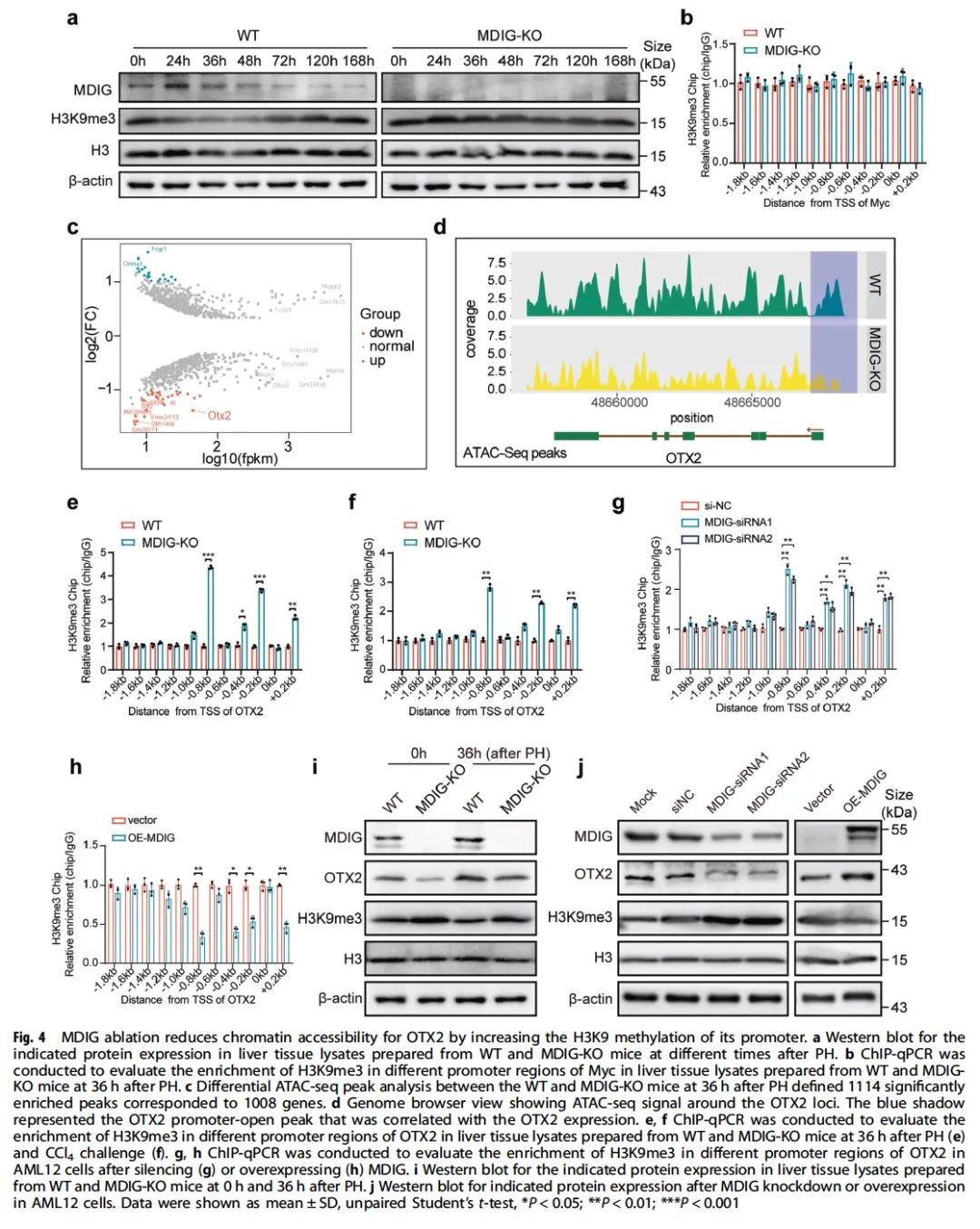
进一步采用ATAC、CUT&Tag等技术发现敲除MDIG的小鼠,其再生肝脏中 OTX2 位点的染色质可及性降低,MYC 位点染色质可及性却并未改变。结合动物和细胞数据的验证,我们得出MDIG是通过在转录因子OTX2启动子区域去甲基化H3K9me3从而改变染色质的可及性以促进OTX2的转录(图4)。
进一步研究发现,OTX2的表达上调使其能够结合MYC启动子区进而增加MYC的表达。相应的,MDIG的缺失则会导致OTX2在MYC启动子区的结合降低,进而抑制了MYC的表达(图5)。
为了进一步明确MDIG,OTX2,MYC三者之间的调控关系,我们通过细胞和动物实验证明,MDIG通过上调OTX2的表达进而促进MYC的表达(图6)。
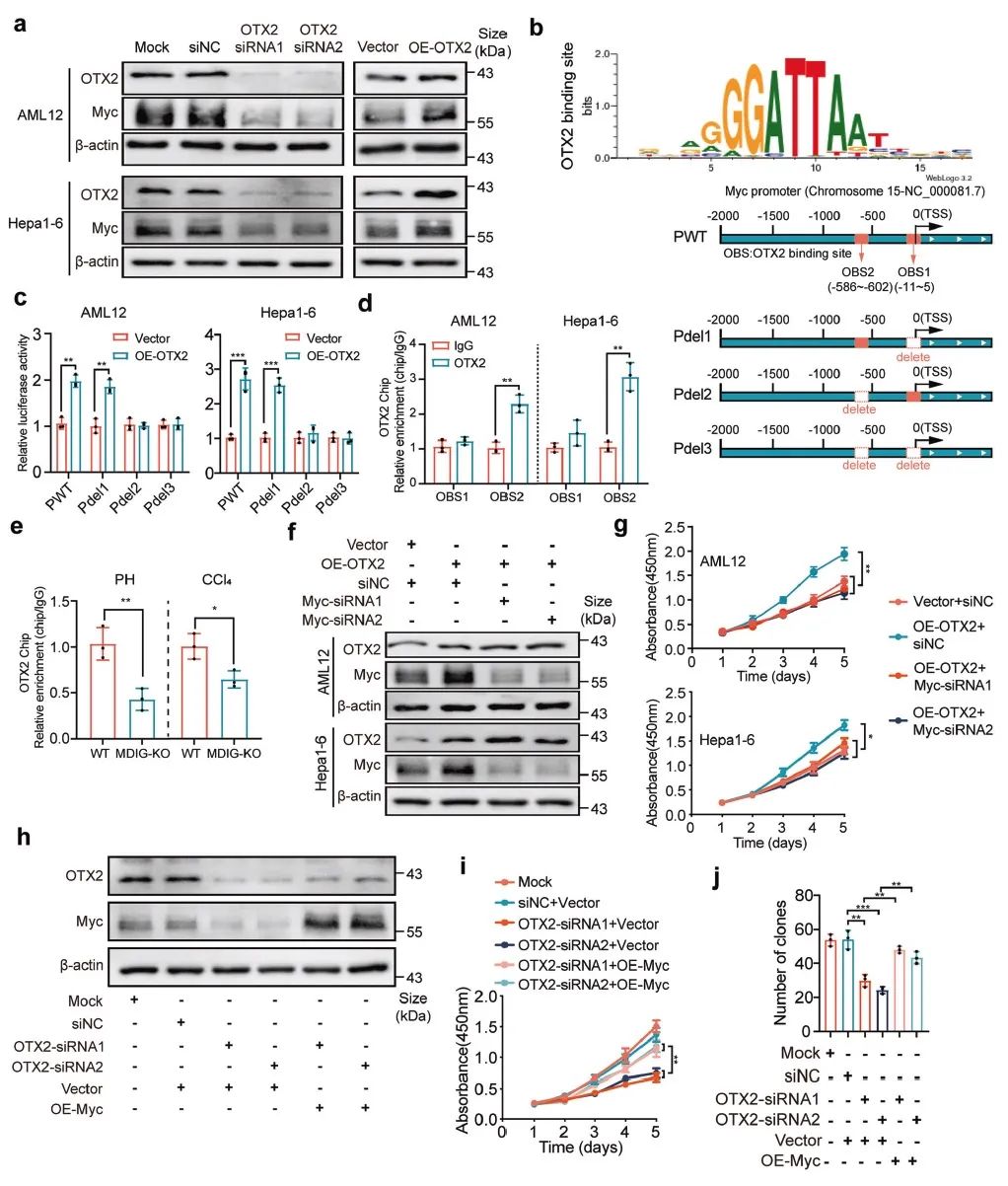
MDIG又叫做MYC诱导的核抗原(MINA),因此我们接下来探究MYC是否作为MDIG的上游分子从而调控MDIG的表达。结果表明,MYC能够通过调节 MDIG 启动子活性来增强 MDIG 表达,从而整体上形成MYC-MDIG正反馈环循环以维持肝细胞增殖。最后我们通过过表达小鼠肝脏中的MDIG建立肝切除模型、动物Rescue实验以及细胞中的反复验证,充分证明了上述结论的准确性(图7)。
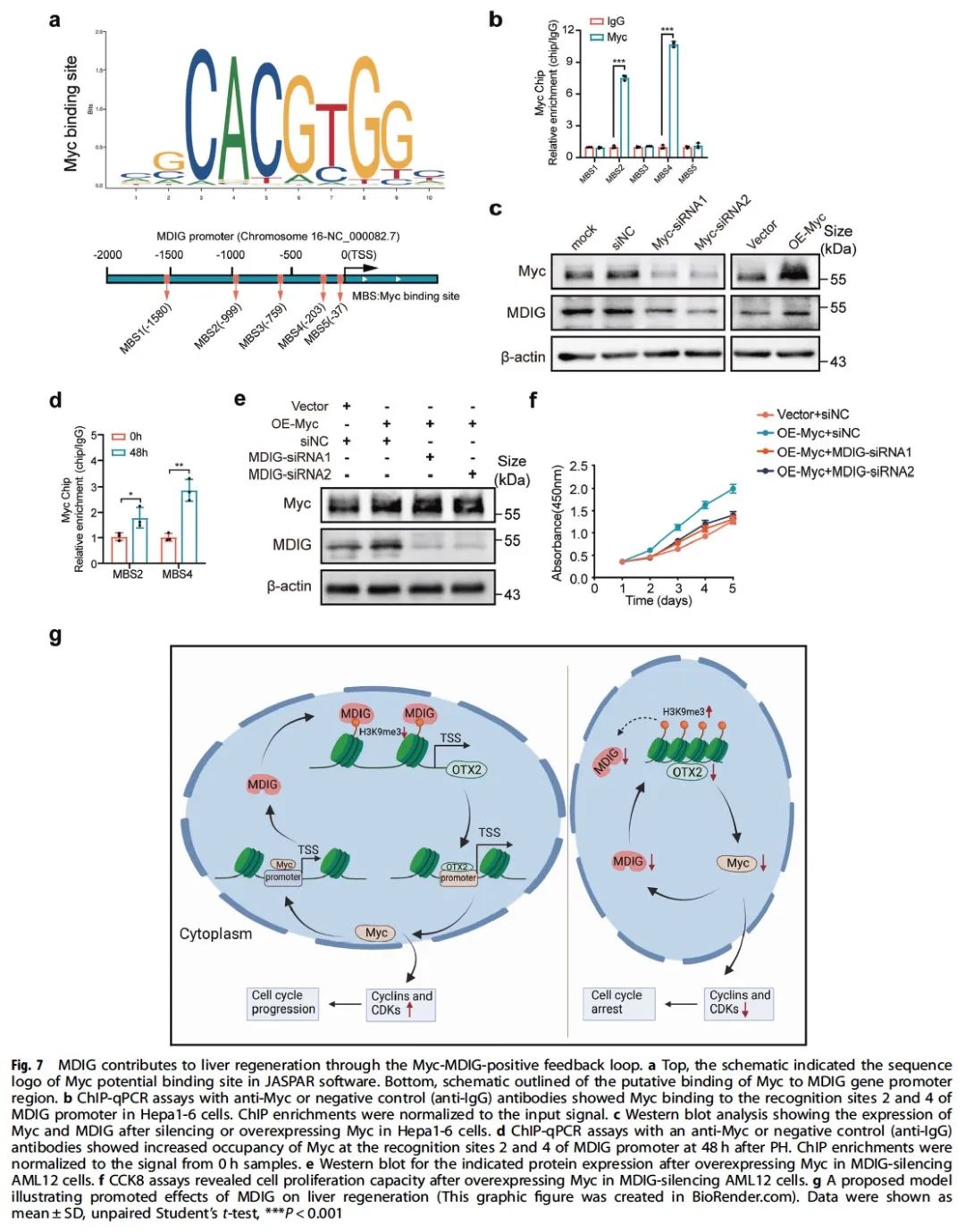
综上,本研究中我们发现肝再生过程中的表观遗传因子MDIG能够通过调控组蛋白甲基化改变染色质的可及性进而在肝再生过程中发挥重要作用,为肝再生过程中的表观转录组调控提供了重要依据。
本文MYC,OTX2过表达质粒,MDIG过表达慢病毒等产品均由吉凯基因提供,助力高水平的科学研究。

公众号底部菜单栏【新功能】上线!
病毒实验帮
免费在线学习《国自然热点研究》、《数据库及软件操作教程》
一键下载《病毒使用手册》、《高分文献》
还有不定时的送新书、抽奖活动,赶紧来扫码关注一波吧
第一作者
杜锦鹏,博士毕业于四川大学华西医学院,研究方向为肝脏肿瘤及肝再生的临床与基础研究。
