为帮忙大家更快了解最新科研进展,掌握科研热点,扩展科研思路,伯豪生物特此推出最新高分文献速递系列推文。本期是2024年8月最新发表的空间转录组相关高分文献集萃,包含三篇空间转录生信方法学文章!
1
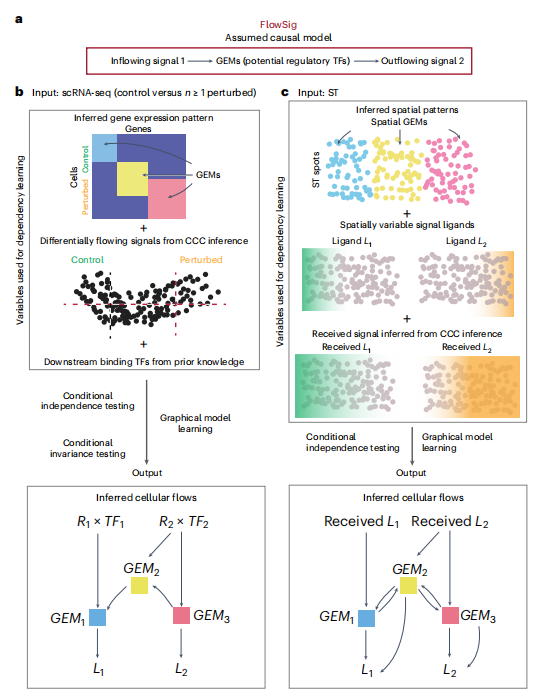
高分文献一:从单细胞和空间转录组学推断模式驱动的细胞间流动

文章标题:Inferring pattern-driving intercellular flows from single-cell and spatial transcriptomics
期刊:nature methods
影响因子:36.1
文章摘要:从单细胞 RNA 测序(scRNA-seq)和空间转录组学(ST)中,我们可以提取出高维基因表达模式,这些模式可以用细胞间通信网络或解耦基因模块来描述。这两种信息流描述通常被认为是独立发生的。然而,细胞间通信会驱动由细胞内基因模块介导的定向信息流,进而触发其他信号的流出。目前还缺乏描述这种细胞间信息流的方法。我们介绍的 FlowSig 是一种利用图形因果建模和条件独立性从 scRNA-seq 或 ST 数据中推断通讯驱动的细胞间信息流的方法。我们使用新生成的皮质类器官实验数据和数学建模生成的合成数据对 FlowSig 进行了基准测试。我们通过将 FlowSig 应用于各种研究来证明它的实用性,结果表明 FlowSig 可以捕捉刺激诱导的胰岛旁分泌信号的变化,证明 COVID-19 严重程度增加导致的细胞间流的变化,以及重建小鼠胚胎发生中形态发生驱动的激活剂-抑制剂模式。
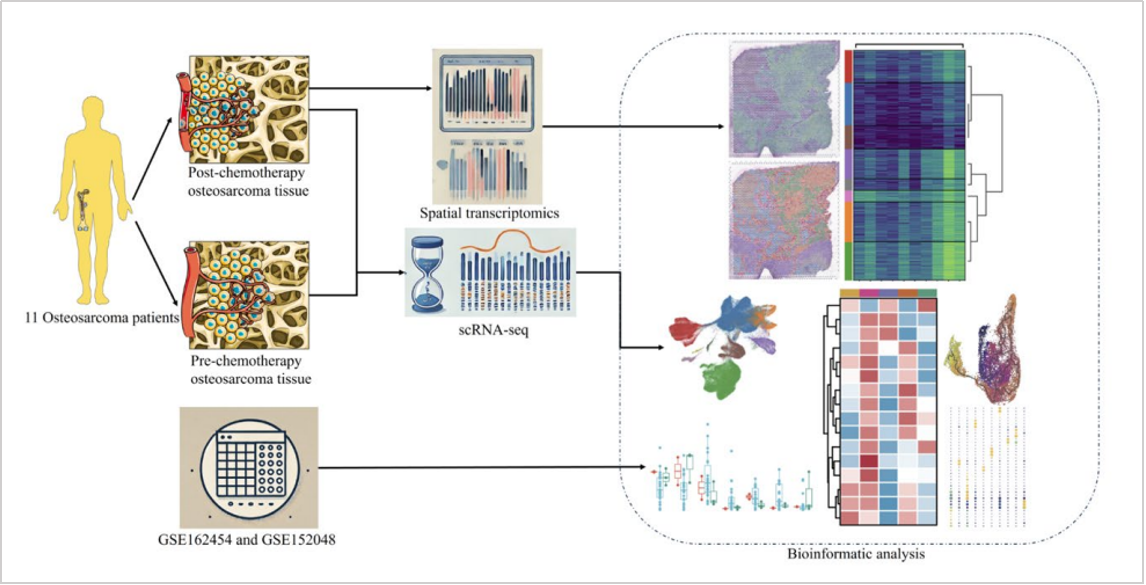
高分文献二:人骨肉瘤单细胞及空间分辨率图谱

文章标题:A single-cell and spatially resolved atlas of human osteosarcomas
期刊:Journal of Hematology & Oncology
影响因子:29.5
文章摘要:骨肉瘤是一个错综复杂的细胞生态系统,其中异型相互作用对疾病进展和治疗效果有着重要影响。尽管骨肉瘤非常重要,但人们对其细胞组成和组织结构的详细了解却仍是空白。在本研究中,我们对人类骨肉瘤进行了全面的单细胞和空间转录组学分析。我们构建了细胞元图谱来剖析空间转录组数据,揭示了骨肉瘤组成亚群的详细图谱。我们细致地描述了每个亚群的独特基因特征和功能状态,并研究了化疗对这些细胞亚群的影响。此外,我们的空间转录组学分析还发现了一个独特的空间生态位,它位于肿瘤坏死区的最前沿,可能与化疗耐药性有关。还深入研究了不同细胞亚群之间的相互影响。这项研究为骨肉瘤的细胞结构提供了一个全面的转录图谱,丰富了对其复杂性的理解,并为更有针对性的治疗方法奠定了基础。
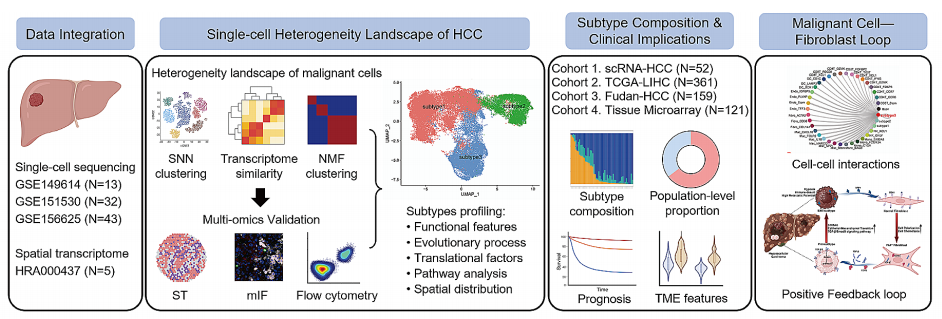
高分文献三:肝癌的单细胞肿瘤异质性:揭示转移前亚型及其与成纤维细胞的相互作用

文章标题:Single-cell tumor heterogeneity landscape of hepatocellular carcinoma: unraveling the pro-metastatic subtype and its interaction loop with fibroblasts
期刊:Molecular Cancer
影响因子:27.7
文章摘要:肿瘤的异质性对于理解驱动肿瘤进展和转移的机制是一个巨大的挑战。肝细胞癌(HCC)在细胞水平上的异质性尚不清楚。作者通过整合52个单细胞RNA测序数据和5个空间转录组学数据,建立了HCC恶性细胞的异质性图谱。在肿瘤细胞中发现了三种亚型,包括 ARG1+代谢亚型(Metab-subtype)、TOP2A+增殖表型(Prol-phenotype)和 S100A6+转移亚型(EMT-subtype)。富集分析发现,这三种亚型具有不同的特征,即新陈代谢、增殖和上皮-间质转化。轨迹分析显示,Metab亚型和EMT亚型都起源于Prol表型。转录因子分析发现,EMT亚型显示出SMAD3和TGF-β信号通路的独家激活。以 EMT 亚型细胞为主的 HCC 预后不良。EMT-亚型肿瘤细胞可通过分泌 SPP1 招募纤维细胞,从而形成有利于肿瘤侵袭转移的肿瘤微环境。总之,作者的研究为HCC的肿瘤异质性提供了先前未知的见解,并确定了转移的潜在靶点。
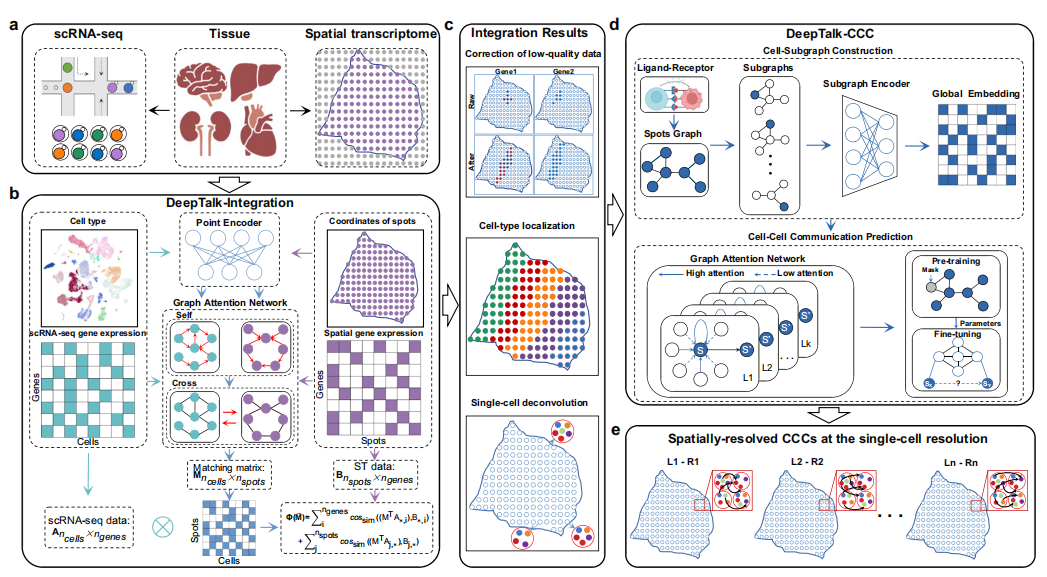
高分文献四:结合图注意力网络和子图技术,在单细胞分辨率上推断空间细胞-细胞通讯

文章标题:Deciphering cell–cell communication at single-cell resolution for spatial
transcriptomics with subgraph-based graph attention network
期刊:Nature Communications
影响因子:14.7
文章摘要:细胞-细胞通讯(CCC)的推断对于更好地理解生物系统中复杂的细胞动力学和调控机制至关重要。然而,在单细胞分辨率下准确推断空间细胞通讯仍是一项重大挑战。为了解决这个问题,我们提出了一种名为 DeepTalk 的多功能方法,通过整合单细胞 RNA 测序(scRNA-seq)数据和空间转录组学(ST)数据,以单细胞分辨率推断空间 CCC。DeepTalk利用图注意网络(GAT)整合scRNA-seq和ST数据,从而实现单细胞ST数据的精确细胞类型鉴定和基于斑点的ST数据的去卷积。然后,DeepTalk 利用基于子图的 GAT 捕获多层次的细胞间联系,进一步实现单细胞分辨率的空间分辨 CCC 推断。DeepTalk 在多个跨平台数据集上发现有意义的空间 CCC 方面表现出色,这证明了它在错综复杂的生物过程中剖析细胞行为的卓越能力。
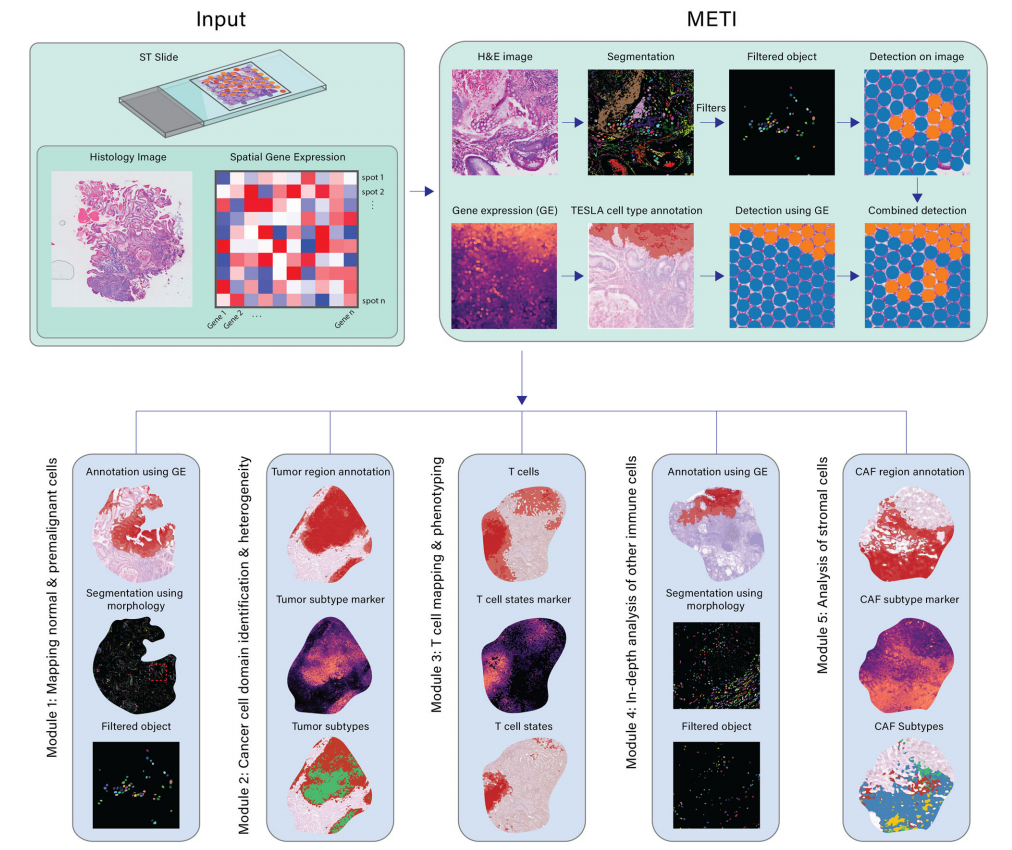
高分文献五:METI:通过整合细胞形态学和空间转录组学深入分析肿瘤生态系统

文章标题:METI: deep profiling of tumor ecosystems by integrating cell morphology and spatial transcriptomics
期刊:Nature Communications
影响因子:14.7
文章摘要:空间转录组学(ST)技术的最新进展为了解肿瘤微环境(TME)中的细胞相互作用提供了宝贵的视角。然而,大多数分析工具缺乏对组织学特征的考虑,并且依赖于匹配的单细胞 RNA 测序数据,这限制了它们在 TME 研究中的有效性。为了解决这个问题,我们引入了形态学增强空间转录组分析集成器(METI),这是一个端到端的框架,可以映射癌细胞和TME成分,对细胞类型和状态进行分层,并分析细胞共定位。METI 将空间转录组学、细胞形态学和已策划的基因特征整合在一起,增强了我们对组织内分子景观和细胞相互作用的理解。我们评估了 METI 在各种肿瘤组织(包括胃癌、肺癌、膀胱癌以及恶性肿瘤前组织)生成的 ST 数据上的性能。我们还将 METI 与现有的聚类和细胞解旋工具进行了定量比较,证明了 METI 强大而稳定的性能。