酸、甜、苦、鲜、咸这五种基本的味觉信息都由中枢味觉系统负责检测和响应[1]。其中甜味和鲜味的味觉受体细胞(taste-receptor cells,TRCs)负责促进摄入能量丰富和蛋白质丰富的食物[2]。而苦和酸味的受体则帮助动物识别有毒和变质的食物,并对其产生厌恶[3]。在过去的研究中人们已经发现TRCs将感知到的味觉信息传递到孤束核头侧(rNTS),随后依次传递到臂旁核、丘脑腹侧后内侧核,最后到达处理味觉信息最高等级中枢-味觉皮层(Gustatory cortex)[4]。味觉皮层又与大脑中负责情绪、进食等的相关脑区交流,从而驱动唤醒味觉相关的行为[5]。
当动物寻找食物时,短期味觉记忆可为动物提供近期味觉体验,为动物提供实时比较潜在食物来源,做出适当的选择。2023年11月8日美国哥伦比亚大学的Charles S. Zuker团队在Neuron杂志上发表文章揭示味觉皮层兴奋性神经元持续激活形成的记忆印迹维持短期味觉记忆的工作机制[6]。Charles S. Zuker团队也是味觉领域重要的奠基人。

研究人员首先建立了一个形成短期味觉记忆的行为实验范式:具体操作为A气味伴随甜味溶液出现时,小鼠需要选择左侧出水口获得奖赏;A气味伴随苦味溶液出现后,小鼠需要特定延迟期内选择右侧出水口获得水奖赏;B气味伴随糖溶液出现后,小鼠需要选择右侧出水口获得水奖赏;B气味伴随苦溶液出现后,小鼠则需要选择左侧出水口获得水奖赏。通过一段时间的训练,小鼠可以在随机可变的时间内做出特定气味相对应的味觉溶液的位置,获得奖赏,形成短期味觉记忆(图1A)。但研究者们也观察到随着延迟期的延长A气味相关的糖溶液和苦味溶液任务完成准确率逐渐降低,但B气味相关的糖溶液任务的完成则不受延迟期间长度的影响(图1B)。
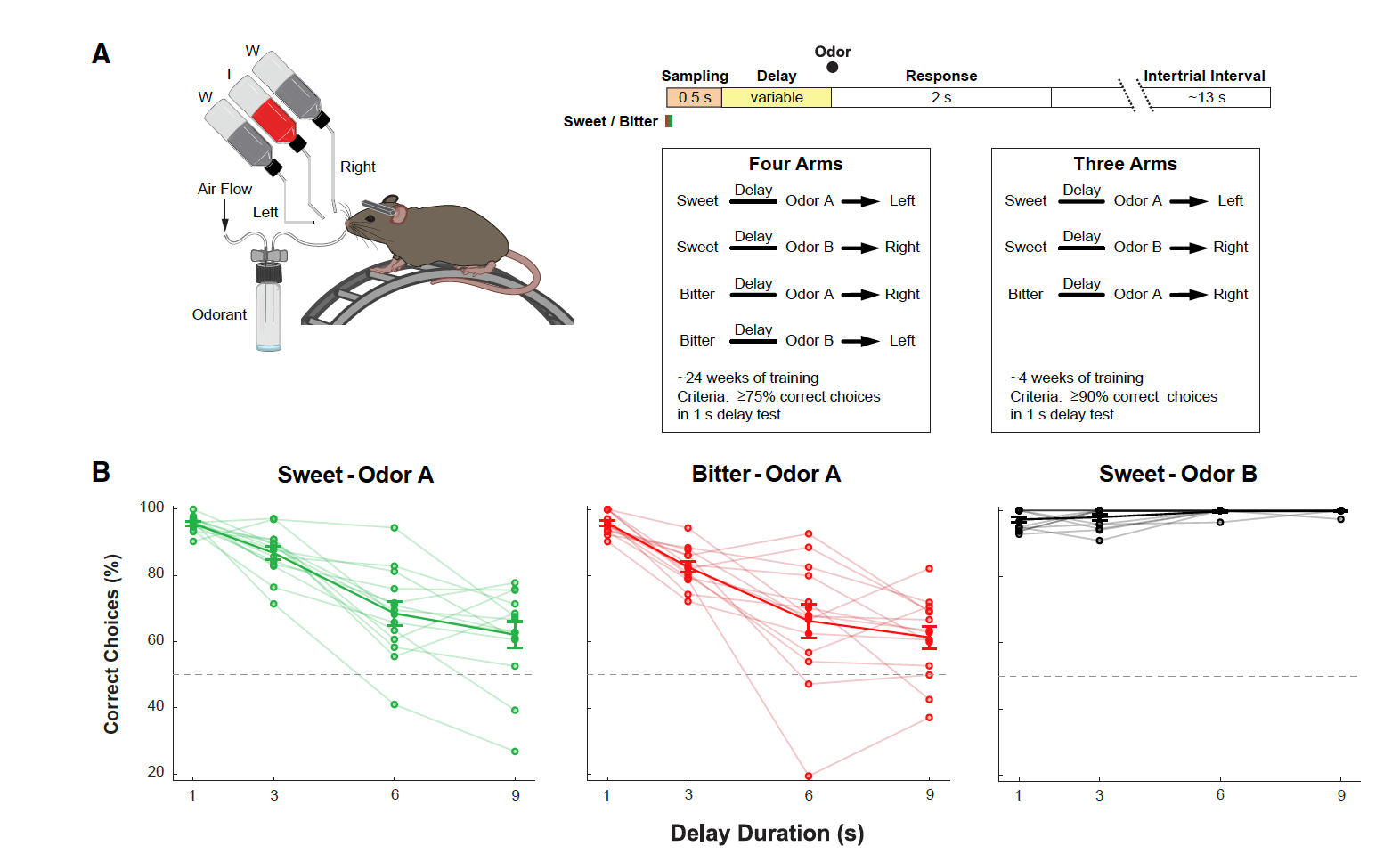
图1.短期味觉记忆行为实验范式的建立
接下来研究者们对主要响应苦味刺激的核团:岛叶皮层的后部神经元(Gustatory Cortex-bitter,GCbt)进行了观察。在向小鼠GCbt区注射AAV-CaMKII-Cre及AAV-Synapsin-Flex-GCaMP6s病毒后,研究者们通过光纤记录的方式观察了GCbt神经元的电活动(图2A)。研究结果显示苦味刺激(Cyx,Quinine)会显著激活GCbt的神经元(图2C),而在味觉受体缺失(TRPM5 KO)的动物中,几乎观察不到GCbt的电活动(图2D)。但在短期味觉记忆模型中,可以持续观察到GCbt神经元钙活动(图3B-D)。
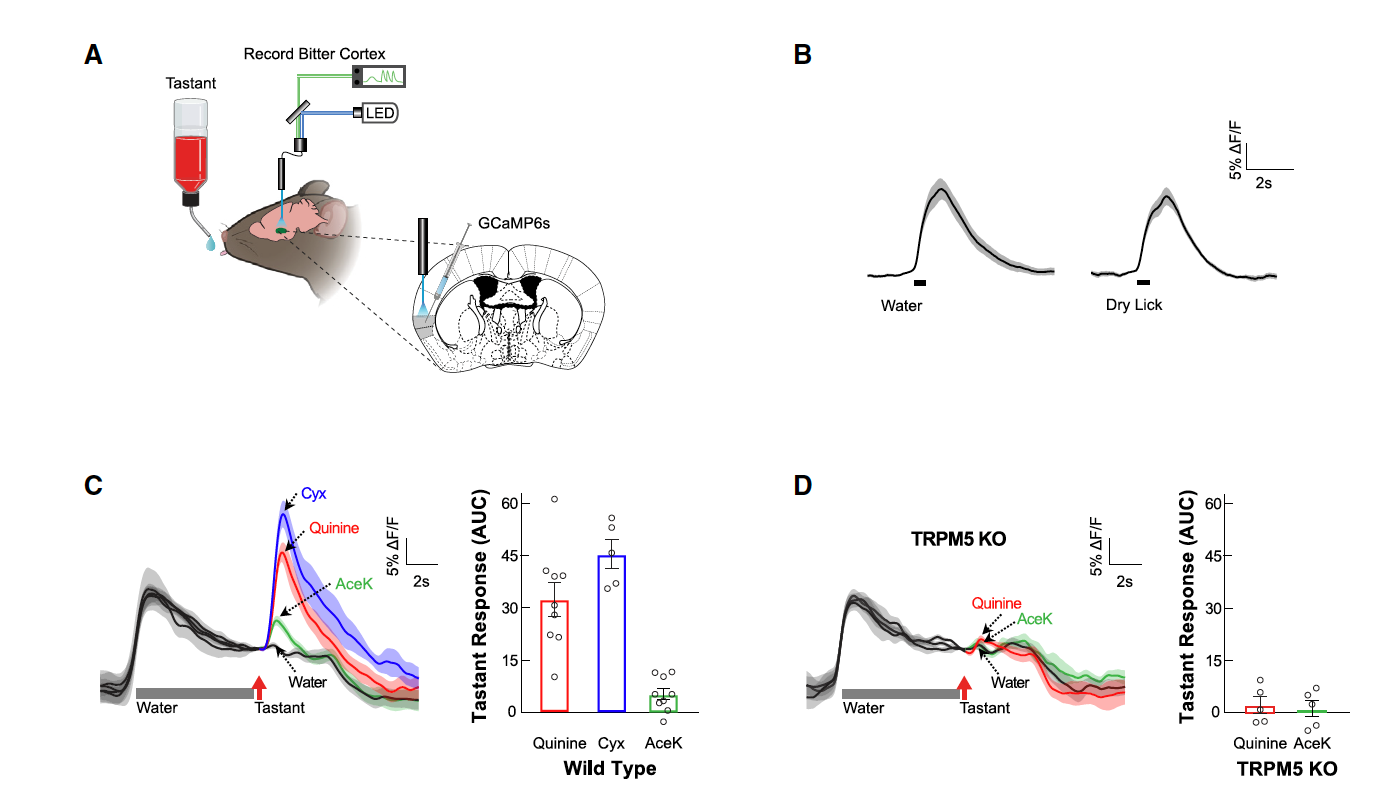
图2. 苦味刺激会引起GCbt神经元响应
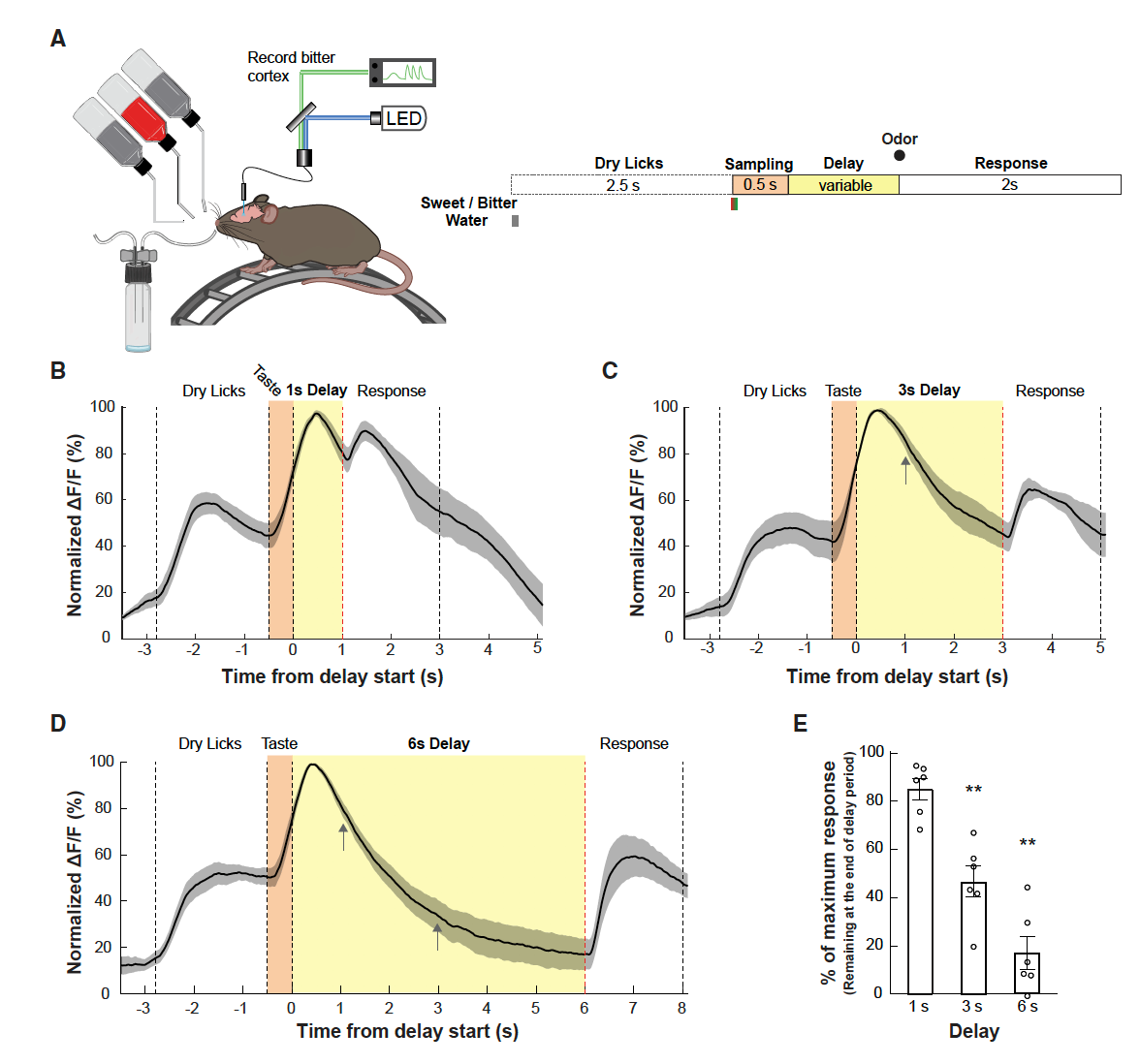
图3. 短期味觉记忆模型中GCbt神经元持续激活
为了排除GCbt的持续激活是由于舌头上残余的苦味物质引起的,研究人员通过光遗传学结合钙成像排除了这个原因。研究者们在rNST区域(向脑内传输苦味信号的中间核团)中注射AAV-EF1a-DIO-hChR2,模拟舌头对苦味的感受。并同时向GCbt注射AAV-CamKIIGCaMP6s记录GCbt的钙活动(图4A)。实验结果显示抑制rNST并不会影响GCbt的激活(图4B)。这个实验也排除了舌头上残余的苦味物质的作用。
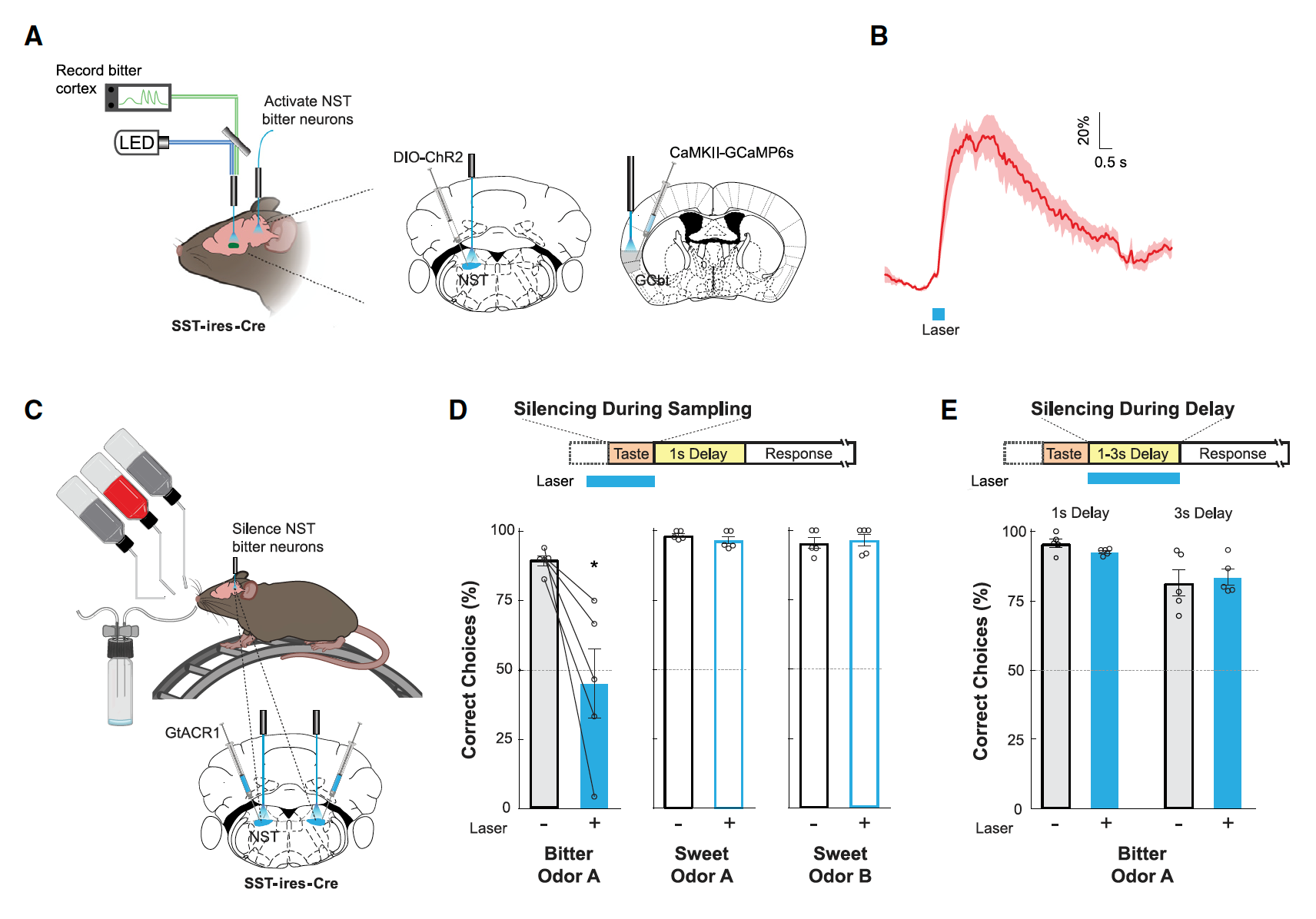
图4.抑制rNST并不会影响GCbt神经元的活动。
那么GCbt的持续激活是否与短期味觉记忆存在相关性?于是研究人员对GCbt进行了更深入的观察。他们首先发现在延长延迟期时,小鼠对短期味觉记忆测试的正确率会升高(图5B),甚至可以从60%提高至80%(图5C-E),这个实验结果表明GCbt的持续激活与动物的短期记忆表现相关。于是研究者们进一步通过光遗传学操纵GCbt神经元(向GCbt区注射AAV-DIO-ChR2)并对其短期记忆的表现进行了评估。实验结果显示在苦味刺激期间和delay期间抑制GCbt神经元都能抑制动物对苦味的记忆(图6A、B),而激活GCbt的VIP神经呀可以抑制GCbt中抑制性神经元的活动,从而可以解除对GCbt神经元的抑制,结果发现动物对苦味的记忆会显著延长(图6C)。
综上,这项工作以苦味记忆为例,解析了GCbt神经元维持短期苦味记忆的神经生物学机制。
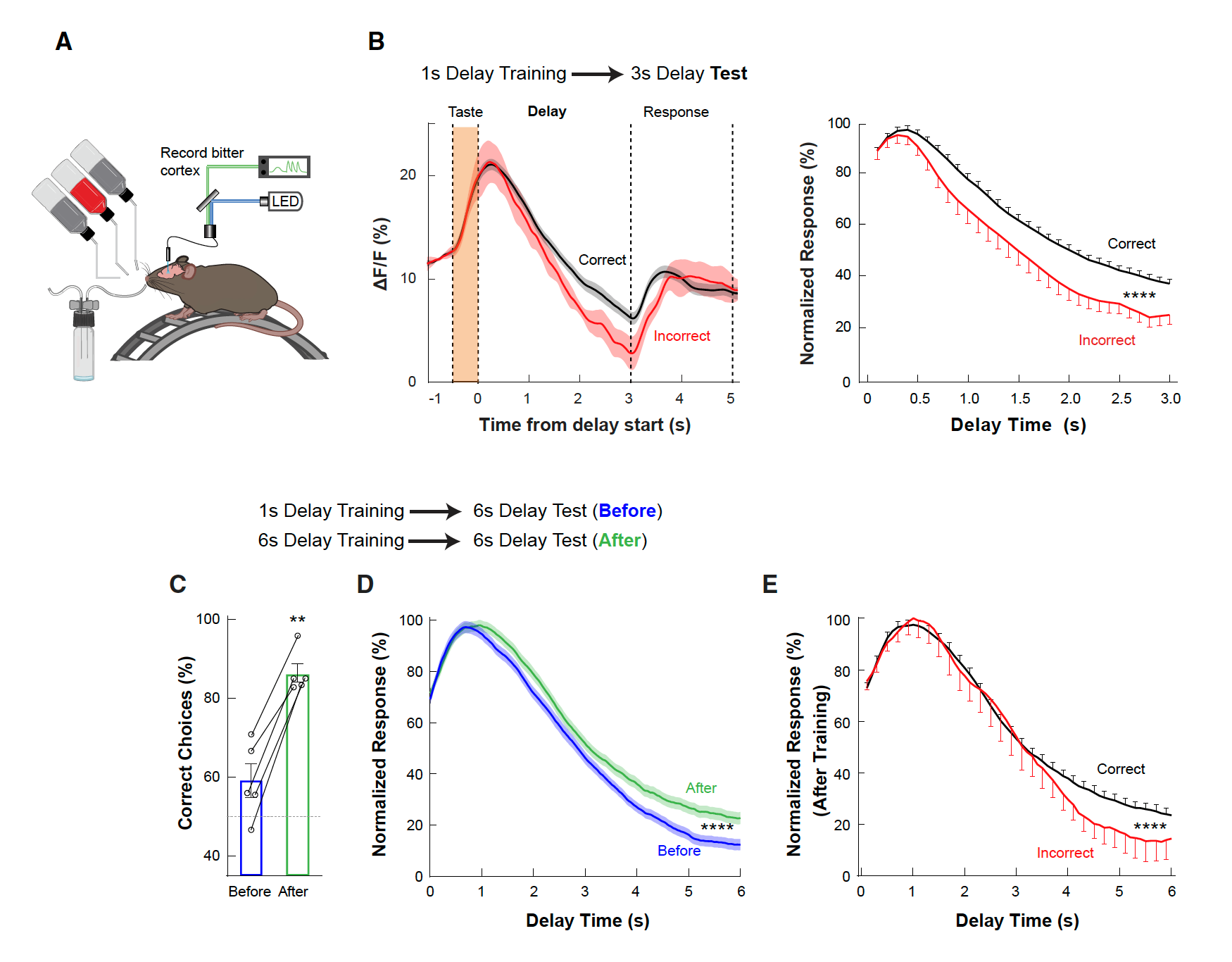
图5. GCbt的持续激活与小鼠短期记忆任务正确率呈正相关
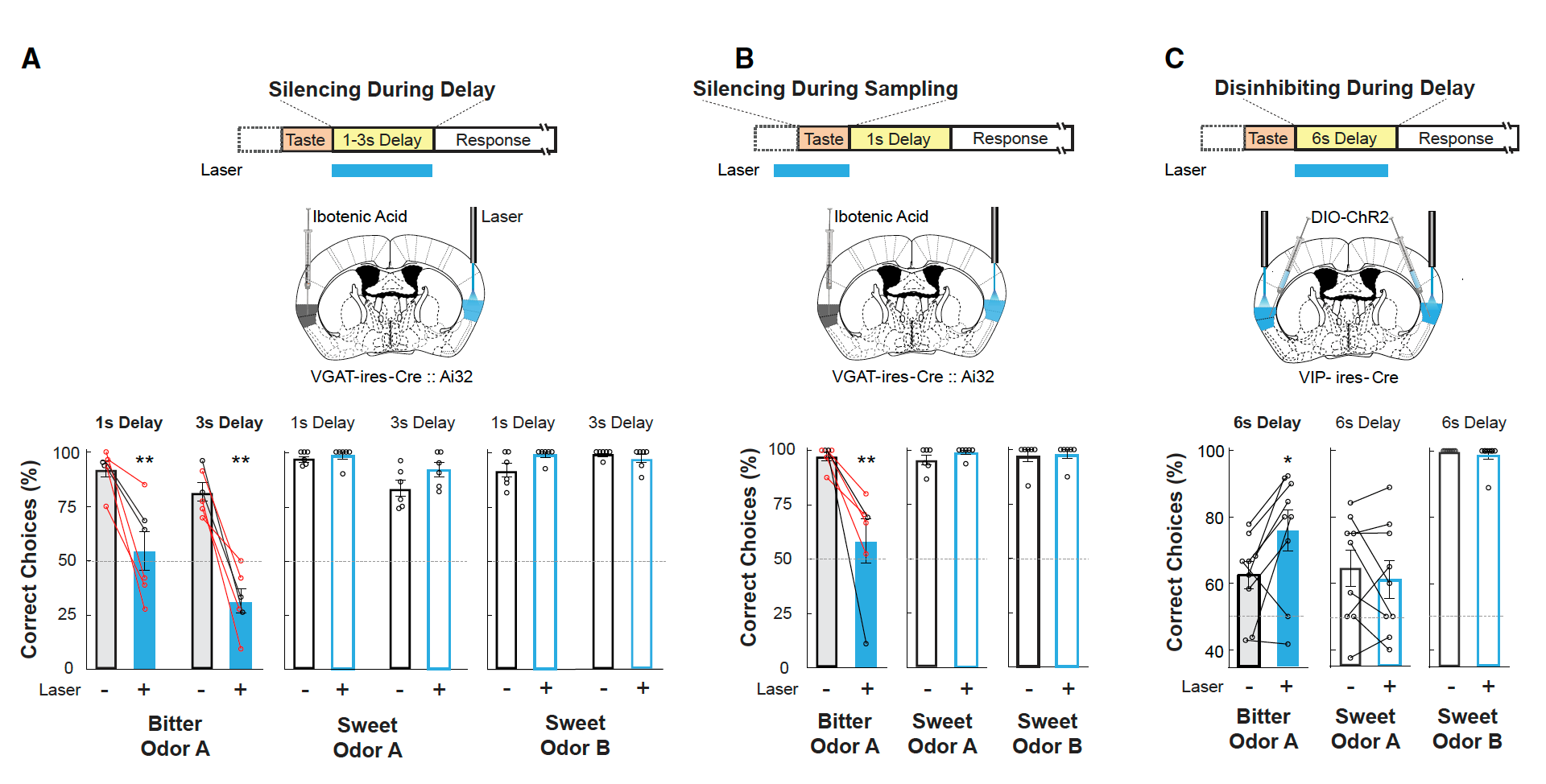
图6. 抑制GCbt神经元活动可减弱动物苦味记忆
参考文献…
[1] Yarmolinsky, D.A., Zuker, C.S., and Ryba, N.J.P. (2009). Common sense about taste: from mammals to insects. Cell 139, 234–244. https://doi.org/10.1016/j.cell.2009.10.001.
[2] Zhao, G.Q., Zhang, Y., Hoon, M.A., Chandrashekar, J., Erlenbach, I.,Ryba, N.J.P., and Zuker, C.S. (2003). The receptors for mammalian sweetand umami taste. Cell 115, 255–266. https://doi.org/10.1016/S0092-8674(03)00844-4.
[3] Mueller, K.L., Hoon, M.A., Erlenbach, I., Chandrashekar, J., Zuker, C.S., and Ryba, N.J.P. (2005). The receptors and coding logic for bitter taste.Nature 434, 225–229. https://doi.org/10.1038/nature03352.
[4] Zhang, J., Jin, H., Zhang, W., Ding, C., O’Keeffe, S., Ye, M., and Zuker,C.S. (2019). Sour sensing from the tongue to the brain. Cell 179, 392–402.e15.https://doi.org/10.1016/j.cell.2019.08.031.
[5] Wang, L., Gillis-Smith, S., Peng, Y., Zhang, J., Chen, X., Salzman, C.D.,Ryba, N.J.P., and Zuker, C.S. (2018). The coding of valence and identityin the mammalian taste system. Nature 558, 127–131. https://doi.org/10.1038/s41586-018-0165-4.
[6] Juen et al., A neural substrate for short-term taste memories, Neuron (2023), https://doi.org/10.1016/j.neuron.2023.10.009(原文)
