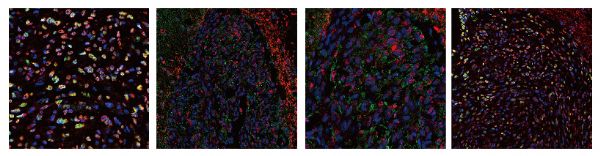
扫描电镜/透射电镜/免疫荧光/激光共聚焦/高内涵活细胞成像
产品名称: 扫描电镜/透射电镜/免疫荧光/激光共聚焦/高内涵活细胞成像
英文名称: Western Biotechnology Inc
产品编号:
产品价格: 欢迎来电详询023-65316016,023—65316556
产品产地: null
品牌商标: null
更新时间: 2023-11-16T15:05:01
使用范围: null
扫描电镜/透射电镜/激光共聚焦
扫描电镜
扫描电镜取材要求:
由于电镜电子束穿透能力的限制,必须把标本切成厚度小于0.1um以下的薄片才适用,这种薄片称为超薄切片。常用的超薄切片厚度是50-70nm。
在透射电镜的样品制备方法中,超薄切片技术是最基本、最常用的制备技术。超薄切片的制作过程基本上和石蜡切片相似,需要经过取材、固定、脱水、浸透、包埋聚合、切片及染色等步骤。
小提示:
透射电镜标本先应用超薄切片机(Ultrotome)进行切片,再经戊二醛和饿酸双重固定,丙酮脱水,环氧树脂包埋,超薄切片,醋酸枸椽酸电子又重染色,透射电镜观察。
扫描电镜标本经戊二醛和饿酸双重固定,乙醇逐级脱水,CO2临界点干燥,真空喷金,扫描电镜观察。
透射电镜
透射电子显微镜在材料科学、生物学上应用较多。由于电子易散射或被物体吸收,故穿透力低,样品的密度、厚度等都会影响到最后的成像质量,必须制备更薄的超薄切片,通常为50~100nm。所以用透射电子显微镜观察时的样品需要处理得很薄。
常用的方法:超薄切片法、冷冻超薄切片法、冷冻蚀刻法、冷冻断裂法等。对于液体样品,通常是挂预处理过的铜网上进行观察。
样本制备方法:
由于电镜电子束穿透能力的限制,必须把标本切成厚度小于0.1um以下的薄片才适用,这种薄片称为超薄切片。常用的超薄切片厚度是50-70nm。
在透射电镜的样品制备方法中,超薄切片技术是最基本、最常用的制备技术。超薄切片的制作过程基本上和石蜡切片相似,需要经过取材、固定、脱水、浸透、包埋聚合、切片及染色等步骤。
取材的基本要求
组织从生物活体取下以后,如果不立即进行适当处理,会由于细胞内部各种酶的作用,出现细胞自溶现象。此外,还可能由于污染,微生物在组织内繁殖使细胞的微细结构遭受破坏。因此,为了使细胞结构尽可能保持生前状态,必须做到快、小、准、冷:
(1).动作迅速,组织从活体取下后应在最短时间内(争取在1分钟内) 投入2.5%戊二醛固定液。
(2).所取组织的体积要小,一般不超过1mm×1mm×1mm。也可将组织修成1mm×1mm×2mm大小长条形。因为固定剂的渗透能力较弱,组织块如果太大,块的内部将不能得到良好的固定。
(3).机械损伤要小,解剖器械应锋利,操作宜轻,避免牵拉、挫伤与挤压。
(4).操作最好在低温(0℃~4℃)下进行,以降低酶的活性,防止细胞自溶。
(5).取材部位要准确。
取材方法:将取出的组织放在洁净的蜡版上,滴一滴预冷的固定液,用两片新的、锋利的刀片成“拉锯式”将组织切下并修小,然后用牙签或镊子将组织块移至盛有冷的固定液的小瓶中。如果组织带有较多的血液和组织液,应先用固定液洗几遍,然后再切成小块固定。
免疫荧光染色
主要原理是利用抗原抗体之间的特异性结合来显示目的蛋白,主要包括蛋白和一抗结合,其次是带有荧光基团的二抗识别并结合一抗,在激光共聚焦系统下即可观察到荧光。染色程序分为两步,第一步,用已知未标记的抗体(Anti LC3II)加到未知抗原样本上;第二步,加上荧光标记的抗球蛋白抗体或抗IgG、IgM抗体(Anti Alexa Fluor 647)。如果第一步发生了抗原抗体反应,荧光标记的抗球蛋白抗体就会和已结合抗原的抗体进一步结合,从而可鉴定抗原。
我公司可以提供单标、双标及三标的免疫荧光服务。
激光共聚焦
激光共聚焦扫描显微镜(laser confocal scanning microscope)用激光作扫描光源,逐点、逐行、逐面快速扫描成像,扫描的激光与荧光收集共用一个物镜,物镜的焦点即扫描激光的聚焦点,也是瞬时成像的物点。由于激光束的波长较短,光束很细,所以共焦激光扫描显微镜有较高的分辨力,大约是普通光学显微镜的3倍。系统经一次调焦,扫描限制在样品的一个平面内。调焦深度不一样时,就可以获得样品不同深度层次的图像,这些图像信息都储于计算机内,通过计算机分析和模拟,就能显示细胞样品的立体结构。
激光共聚焦扫描显微镜既可以用于观察细胞形态,也可以用于细胞内生化成分的定量分析、光密度统计以及细胞形态的测量。
高内涵活细胞成像
高内涵细胞成像分析系统由三个部分组成:全自动高速显微成像,全自动图像分析和数据管理。全自动高速显微成像在短时间内生成大量的图像,全自动图像分析从这些图像中提取大量的数据,数据管理软件负责建档存储、注释比较、检索分享这些图像和数据。
高内涵技术最初应用于药物筛选,随着技术的进步和发展,近年来在生命科学研究中得到了广泛的应用,包括细胞信号通路,肿瘤学,神经生物学,免疫学,传染病学,干细胞的研究等等。HCA提供的信息不可能从传统方法中获得,很多实验用高内涵平台来完成,比现有的方法更灵敏,通量更高,成本更低,结果更准确和可靠。
其中高内涵筛选(HCS)是一套自动化分析方法,利用整合的显微镜、图像处理技术及可视化工具从细胞或细胞群中提取数据,获得定量分析结果。HCS一般应用于高通量的样品荧光成像,提供定量分析结果。此外,HCS能够结合单个细胞的多重检测结果,同时分析单次实验中的多个细胞亚群。
高内涵筛选的技术优势:
- 高内涵筛选可在保持细胞结构和功能完整性;
- 同时检测被筛样品对细胞形态、生长、分化、迁移、凋亡、代谢途径及信号转导等各个环节的影响;
- 在单一实验中获取大量相关信息,确定其生物活性和潜在毒性。
威斯腾实验服务流程
威斯腾生物服务项目
| 分子生物学检测 | 蛋白质与免疫学 | 动物实验 |
| 实时荧光定量PCR | 单克隆抗体制备 | 帕金森疾病模型 |
| 免疫共沉淀(Co-IP) | 多克隆抗体制备 | 抑郁症动物模型 |
| ELISA(酶联免疫吸附法)技术 | Western-blot 实验服务 | 脊髓损伤模型 |
| 生化指标检测 | 蛋白双向电泳实验服务 | 脑外损伤模型 |
| 双荧光素酶报告基因检测 | 原核蛋白表达纯化 | 骨神经损伤模型 |
| 染色质免疫共沉淀(ChIP) | 真核蛋白表达纯化 | 心肌缺血模型 |
| GST pull Down | ITRAQ定量蛋白质组学 | 心力衰竭模型 |
| SLAC蛋白组学 | 肺动脉高血压动物模型 | |
| 高血压模型 | ||
| 病毒包装 | 实验课题整体外包 | 粥样动脉硬化模型 |
| 过表达/干扰慢病毒包装纯化 | 整体课题外包 | 大脑中动脉阻塞模型 |
| 过表达/干扰腺病毒包装纯化 | 细胞整体实验外包 | 慢性之气管炎模型 |
| 逆转录病毒包装纯化 | 动物整体实验外包 | 过敏性哮喘模型 |
| 腺相关病毒包装纯化 | 肺炎大鼠模型 | |
| 肝炎-肝硬化-肝癌模型 | ||
| 蛋白芯片 | 原代细胞培养 | 肝纤维化模型 |
| 细胞因子芯片 | 骨髓间充质干细胞培养 | 胆结石模型 |
| BioPlex悬浮芯片 | 脂肪干细胞培养 | 急性胰腺炎模型 |
| 生长因子芯片 | 心肌成纤维细胞培养 | 急性肾衰竭模型 |
| 炎症因子芯片 | 软骨细胞培养 | 体内血栓模型 |
| 血管生成因子芯片 | 血管内皮细胞培养 | 关节炎模型 |
| 凋亡因子芯片 | 神经元细胞培养 | I型和II型糖尿病模型 |
| 趋化因子芯片 | 内皮组细胞原代培养 | 裸鼠成瘤 |
| HuProt TM 20K人类蛋白组芯片 | 基因编辑动物 | |
| 电生理相关服务 | 动物整体实验服务 | |
| 膜片钳实验 | ||
| 细胞生物学检测 | 高通量测序 | 代谢组学 |
| 细胞原代培养 | mRNA测序 | 气相色谱GC/MS |
| MTT检测 | LncRNA测序 | 液相色谱LC/MS |
| 细胞凋亡检测 | 全基因组测序 | 核磁共震NMR |
| 细胞周期检测 | RNA-Seq测序 | |
| 细胞克隆形成实验 | 外显子测序 | 影像学相关实验 |
| Transwell细胞迁移/侵袭 | 16s扩增子测序 | Micro-CT |
| 流式分选 | Small RNA测序 | 小动物活体成像 |
| CCK8/XTT检测 | 宏基因组测序 | 核磁共振 |
| 台盼蓝检测细胞活性 | 单细胞测序 | PET-CT |
| 药物筛选细胞学实验 | circleRNA测序 | |
| 细胞粘附性检测 | 甲基化测序 | 基因编辑动物 |
| 细胞划痕实验 | 条件性敲除小鼠/大鼠 | |
| 细胞生物学整体实验 | 全基因敲除小鼠/大鼠 | |
| 细胞成管实验 | ||
| 病理检测 | CRISPR/Cas9细胞敲除/敲入 | 基因芯片 |
| 扫描电镜 | 基因定点突变细胞系 | LncRNA芯片 |
| 透射电镜 | 单基因敲除细胞系 | miRNA芯片 |
| HE染色 | 多基因敲除细胞系 | mRNA芯片 |
| 免疫组化 | 目的基因敲入细胞系 | 甲基化芯片(限人和小鼠来源样本) |
| Tunel(原位末端凋亡法)检测 | 报告基因敲入细胞系 | SNP芯片(限人和小鼠来源样本) |
| 激光共聚焦 | miRNA/LncRNA敲除细胞系 | |
| 免疫荧光 | ||
| Masson染色 | CRISPR/Cas9动物敲除/敲入 | 科研设计指导&文章评估/润色 |
| 原位杂交 | 基因敲除大鼠/小鼠 | 科研文献论著翻译 |
| 荧光原位杂交 | 基因敲入大鼠/小鼠 | 论文翻译润色服务 |
| 特殊染色(PSA、茜素红、阿尔新蓝等) | 临床实验/科研实验设计方案指导 | |
| 行为学检测 | TUNEology 波长可调检测卡盒-->
|