分化的HepaRGTM细胞是独特的人类双能细胞,能够形成类似胆道和类似肝细胞的细胞。它们表达多种解毒酶,广泛用于早期药物发现中的肝毒性检测。在这项研究中,我们展示了高通量和高效形成高功能性的HepaRGTM球体细胞,它们通过spheroONE的分选和分离,以获得每孔含有均匀的单个HepaRGTM球体的检测就绪板。
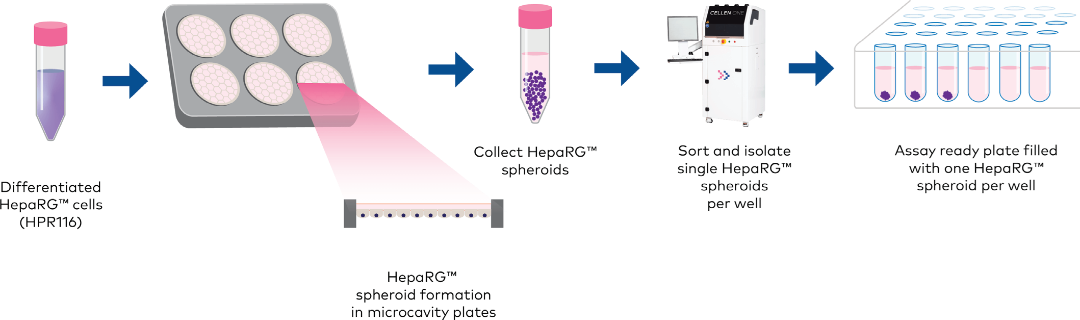

在3D细胞模型的领域中,HepaRGTM人肝细胞系已证明了其在研究肝毒性方面的价值,其代谢特性使其成为抗肿瘤药物筛选模型[2],[3]。药物筛选必须在根据大小和形态选择的球体上进行,这意味着球体必须根据某些预选标准进行分类和分离。
Cellenion 开发了一种创新平台--SpheroONE,用于从大量细胞聚集体中分拣、分离和分配大颗粒(如球体和类器官)。
# 材料与方法
球形体大批量生产
培养基制备:
将冷冻的含抗生素的HepaRGTM预诱导培养基补充剂(ADD610,Biopredic International 公司)
置于 37°C 水浴中直至完全解冻。将解冻的 ADD610 补充剂加入100mL基础肝细胞培养基(MIL600,Biopredic International 公司)中,重新配制HepaRGTM 诱导前培养基,命名为 MIL610。
将冷冻的含抗生素的 HepaRGTM 维护/代谢培养基补充剂(ADD620,Biopredic International 公司)置于 37°C 水浴中直至完全解冻。将解冻的 ADD620 补充剂加入100mL基础肝细胞培养基(MIL600,Biopredic International 公司)中,重新配制HepaRGTM维护/代谢培养基,命名为 MIL620。
细胞播种和类球体形成:
7孔的微腔Elplasia板P24(康宁,型号:4441,每孔包含554个微腔)预先填充了1mL在37°C水浴中预热的MIL610。为了平均每个类球体获得2000个HepaRGTM细胞,将细胞悬液浓度调整至1.11x106细胞/mL的MIL610。将此细胞悬液(1mL/孔)播种到每个预先填充了培养基的孔中,并将板在37°C、5% CO2条件下孵育4天以形成类球体。
样品制备:
在各腔中形成 HepaRGTM 球形体后,将球状体从Elplasia板转移到15 mL的Falcon管中。移除培养基,并将球状体重悬于6 mL无菌PBS(含Ca2+和Mg2+,Corning,参考编号:21-030-CM)中。样品的前半部分在无菌条件下装入3 mL的spheroONE样品储存器中,并安装到spheroONE中开始分选和分离。完全处理后,将剩余的样品装入储存器并安装到spheroONE中进行第二轮球状体分选和分离。
球状体分选与分离:
spheroONE是一种用于大规模细胞聚集体的分选和分离的创新设备。利用精密喷点技术和先进的基于图像的分选能功能,spheroONE可以选择和分离球状体、类器官和类肿瘤体。在以下实验中使用了纳米喷点毛细管(NDC,直径约为300 µm)。
样品储存器被加压(150 mBar),并设置了检测和分离参数,以分离直径在200 µm到250 µm之间的球状体。
四个384孔ULA板(Corning,参考编号:4516)预先填充了30 µL的MIL620。根据spheroONE上预先选择的参数,每孔分离出一个单一的球状体。
分离后的类球体形态:
通过显微镜(Axio observer Z1,5倍物镜,Zeiss)在分离后2天评估球体形态。使用Zen软件工具(Zeiss)测量球体直径。
球体功能性:
在分离球状体后培养2天后,进行了系列的生存率和功能性测试。
使用 ATP 评估类球蛋白酶活力:
使用CellTiter-Glo®3D细胞活力检测试剂盒(Promega,参考文献:G9682)评估球体的活力。该实验按照生产商的协议在一个平底96孔板中对10个随机选择的球体进行检测。使用微孔板扫描仪(FLUOstar Omega Multimode,BMG LABTECH)测量发光度。
使用生死染色法检测球体的活力:
使用Hoechst 33342(5 µg/mL)和溴化乙锭(EtBr)(1 µg/mL)评估球体的活力。球体在30°C的黑暗环境中孵育5分钟,然后用PBS清洗3次。染色后的球体被转移到平底384孔板的孔中,随后使用荧光显微镜(Axio observer Z1,Zeiss)进行成像和分析。
白蛋白分泌:
为了获得足够的体积进行此检测,每次测量时,从包含384孔ULA板的球体的10个随机选择孔中取10 µL上清液并混合在一起。然后根据生产商的协议,使用商业化的人类蛋白ELISA试剂盒(Bethyl Laboratories,参考文献:E88-129)测量白蛋白的分泌。使用微孔板扫描仪(FLUOstar Omega Multimode, BMG LABTECH)测量吸光度。总共进行了3次测量。
大批量球状细胞的制备:
在P24Elplasia板中接种并培养4天后,分化的HepaRGTM细胞形成了紧密聚集的HepaRGTM球体。通过显微镜及其相关软件确定,形成的HepaRGTM球体在大小上是异质的,直径范围大约在150到350微米之间。
球体分离:
在HepaRGTM球体形成后,成功地利用spheroONE进行汇集和处理,以获得每个孔中直径为200到250微米的单个分选球体,这些孔位于4个U形底部ULA 384孔板中。在球体分离后,板子在37°C和5% CO2条件下培养。经过2天培养后,对平板进行成像,记录每孔的单张图像(图1)。
 图1:5x5的显微镜平铺图,展示了在U底ULA 384孔板中分化的HepaRGTM球体。5倍物镜,球体直径:200-250µm。比例尺 = 200µm。
图1:5x5的显微镜平铺图,展示了在U底ULA 384孔板中分化的HepaRGTM球体。5倍物镜,球体直径:200-250µm。比例尺 = 200µm。
从获取的图像中,使用分割工具(Zen Software, Zeiss)测量了100个球体的直径。根据这些测量数据,生成了盒装图(图2),显示球体的平均直径及其大小分布。
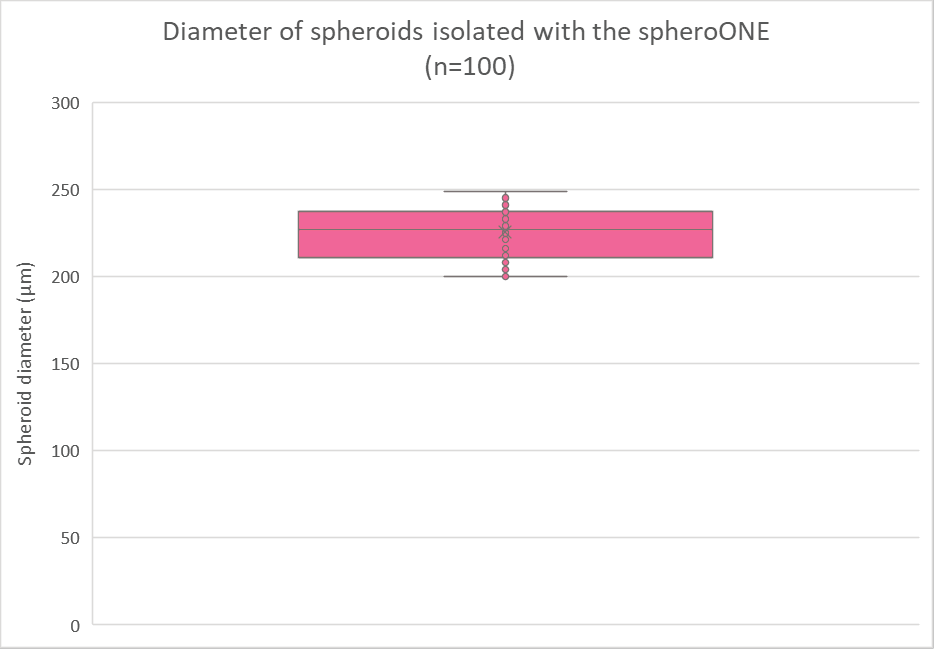
图2:SpheroONE 分离后培养2天的HepaRGTM 球体直径方框图。
这些显微镜图像和直径测量结果证实,所有通过spheroONE分离的HepaRGTM球形体的直径范围在200到249微米之间,平均值为226微米。
球体形态:
对这些显微镜图像的进一步目视检查表明,spheroONE并没有损害球状体的完整性,所有分离的球状体都紧密排列且均匀(图3)。
图3:在 spheroONE分离后培养2天的U底 ULA384孔板中的分化 HepaRGTM球体的显微镜图像。物镜 x5。比例尺 200µm。
球状体功能:
使用ATP评估球状体的活力
根据发光读数,可以使用标准曲线计算每个球状体产生的ATP量。结果显示出良好的重复性,每个球状体产生的ATP在962到1123 nM之间,平均值为1032 +/-23 nM。这个值与Biopredic International的内部质量控制数据一致(由2000个HepaRGTM细胞组成的球状体在ULA 96孔板(Corning Costar®, Ref: 7007)中使用MIL620培养,ATP含量在558到1156 nM之间),表明形成的HepaRGTM球状体显示出良好的活力和能量状态。
使用活死染色法检测球体细胞活力
此外,使用“活死”染色法对一些孤立的球体进行了染色,将其转移到平底384孔板中,随后在荧光显微镜下进行成像,以确定这些球体中是否存在死亡细胞。

图4:在平底384孔板中的分化HepaRGTM球体显微镜图像,在spheroONE分离后培养2天,并进行了活-死染色。物镜x10。比例尺100µm。蓝色染色=存活细胞。红色染色=死亡细胞。
几乎所有的细胞在球状体中都是活的(大多数为蓝色且没有红色),在spheroONE分离后,这些球状体中仅观察到极少数的死细胞(红色)(图4)。
这两种检测方法均确认:
HepaRGTM球状体在使用spheroONE进行分类和分离后,既没有受损,其细胞活力也未受到影响。
白蛋白分泌:
通过吸光度测量和使用标准曲线,可以计算出每组10孔的分泌白蛋白浓度。3次测量的结果显示类器官分泌的白蛋白浓度在49到62 ng/mL之间,平均值为55 +/- 4 ng/mL。这个值与之前发表的数据显示的值一致,表明形成的HepaRGTM类器官表现出良好的功能性。
ATP活力和白蛋白剂量都与Biopredic International在HepaRGTM3D细胞模型质量控制评估期间获得的标准值一致,这确认了通过spheroONE分离的HepaRGTM类器官具有良好的功能。
这些实验确认了通过spheroONE分选和分离能力成功制备了高度均匀的U底ULA 384孔板,每孔填充一个紧密包装、有活力和功能性的单个HepaRGTM类器官。
在这项研究中,我们展示了如何通过自组装轻松准备大量功能性的HepaRGTM肝类球。这些肝类球是使用现成的分化HepaRGTM细胞(来自Biopredic International的HPR116)播种在超低粘附微结构化Elplasia®微孔板中制备的。随后,这些大量的HepaRGTM类球通过spheroONE进行大小分选和分离,以获得高度均一的现成检测板,每孔包含一个类球细胞。功能和存活率检测表明,即用型检测板中的HepaRGTM 球形体在性能上与使用更费力的手工方法制成的球形体相当。总体而言,结合HPR116细胞和spheroONE进行高通量和自动化的方式制备有功能性HepaRGTM球形体的现成检测板,非常适用于在药物发现的不同阶段广泛实施的各种3D肝模型筛选应用。
致谢:
分化的HepaRGTM细胞和培养试剂由
Biopredic International提供给Cellenion。
参考文献:
[1] Fang, Y., & Eglen, R. M. (2017). Three-Dimensional Cell Cultures in Drug Discovery and Development. SLAS Discovery, 22(5), 456-472.
[2] Ferreira, A., Rodrigues, M., Silvestre, S., Falcão, A., & Alves, G. (2014). HepaRG cell line as an in vitro model for screening drug–drug interactions mediated by metabolic induction: Amiodarone used as a model substance. Toxicology in Vitro, 28(8), 1531-1535.
[3] Andersson, T. B., Kanebratt, K. P., & Kenna, J. G. (2012). The HepaRG cell line: A unique in vitro tool for understanding drug metabolism and toxicology in human. Expert Opinion on Drug Metabolism & Toxicology, 8(7), 909-920.
